
【题目】双缩脲反应可以用于测定蛋白质的含量。双缩脲反应的原理可表示如下:

双缩脲 紫红色配离子
(1)Cu2+的基态核外电子排布式为_______。
(2)与H2O互为等电子体的一种阳离子为_______(填化学式)。
(3)双缩脲分子中氮原子轨道的杂化类型是_______;1 mol双缩脲分子中含有σ键的数目为_______。
(4)该紫红色配离子中的配位原子为_______。
(5)Cu3Au的晶胞如下图所示,Cu3Au晶体中每个铜原子周围距离最近的铜原子数目为_______。

【答案】[Ar]3d9或1s22s22p63s23p63d9 H2F+ sp3 11 NA或11×6.02×1023 N、O 8
【解析】
根据构造原理写出铜原子的核外电子排布式,再写出铜离子的核外电子排布式。根据同族替换或等量代换寻找等电子体。根据氮原子的成键类型,判断杂化方式。根据单键是σ键,双键中一个是σ键一个是π键,找到直接和中心原子相连的的配位体的原子是配位原子。根据Cu和Au的位置,找到每个铜原子周围距离最近的铜原子数目。
(1)铜是29号元素,铜原子的核外电子排布式为:[Ar]3d104s1或1s22s22p63s23p63d104s1,Cu2+的基态核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;
(2) H2O的价电子数为8个,原子个数为3个,与H2O互为等电子体的一种阳离子为H2F+;
(3)双缩脲分子中氮原子成三个共价键,含有一个孤电子对,杂化类型是sp3杂化,根据双缩脲分子的结构,单键是σ键,双键中一个是σ键一个是π键,1 mol双缩脲分子中含有σ键的物质的量为11mol,数目为11 NA或11×6.02×1023;
(4)该紫红色配离子中与铜离子直接相连的原子是N、O,配位原子为N、O;
(5)Cu3Au的晶胞中,Cu 位于面心,Au位于顶点,Cu3Au晶体中每个铜原子周围距离最近的铜原子数目为8,位于此晶胞侧面的四个铜原子和位于上面的晶胞的侧面,共8个。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图:

下列说法不正确的是( )
A.易蒙停的分子式为C29H34Cl2N2O3
B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色
C.1mol易蒙停只能与1molNaOH发生反应
D.1mol易蒙停最多能与3mol溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为_______________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:___________________。
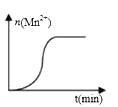
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是合成降压药替米沙坦的重要中间体,其人工合成路线如下:
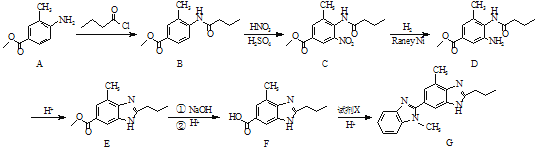
(1)C中含氧官能团的名称为酰胺键、_______和________。
(2)A→B的反应类型为______。
(3)试剂X的分子式为C7H10N2,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①是α-氨基酸;
②苯环上有3种不同化学环境的氢原子。
(5)已知:①苯胺(![]() )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化产物为间二硝基苯
③![]()
![]() CH3COO-+CH3NH2
CH3COO-+CH3NH2
写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。

(2)盐基度[B=![]() × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
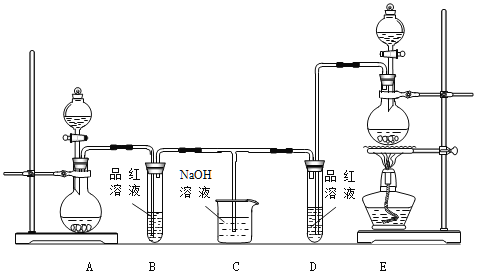
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com