
【题目】盐酸洛派丁胺俗称易蒙停,它是一种新型的止泻药,适用于各种急慢性腹泻的治疗,其结构简式如图:

下列说法不正确的是( )
A.易蒙停的分子式为C29H34Cl2N2O3
B.向易蒙停溶液中加入FeCl3溶液,溶液显紫色
C.1mol易蒙停只能与1molNaOH发生反应
D.1mol易蒙停最多能与3mol溴水发生反应
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g)![]() 2HI(g),平衡后,减压平衡不移动,气体颜色不变
2HI(g),平衡后,减压平衡不移动,气体颜色不变
B.H2(g)+I2(g)![]() 2HI(g),平衡后,加压平衡不移动,气体颜色不变
2HI(g),平衡后,加压平衡不移动,气体颜色不变
C.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色变浅
D.2NO2(g)![]() N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
N2O4(g),平衡后,加压平衡正向移动,气体颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
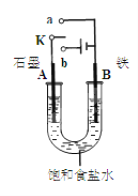
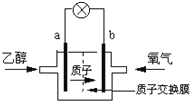
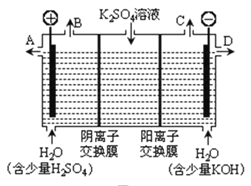
图1图2图3
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电流方向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口____(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如图:

下列有关叙述不合理的是( )
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹 持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.…
(1)A中反应的化学方程式为:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O,则氧化性KMnO4____Cl2(填“>”“<”或“=”)。
(2)验证氯气的氧化性强于碘的实验现象是____。
(3)过程Ⅲ的实验目的是____。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____。
(5)浸有NaOH溶液的棉花团的作用是____。此处发生的化学方 程式是____。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们单质氧化性强弱为:Cl2>Br2>(CN)2>(SCN)2>I2。试写出:在NaBr和KSCN的混合溶液中加入(CN)2的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺是一种重要的有机合成的中间体。它的球棍模型如图所示:(图中“棍”代表单键或双键或三键,不同颜色球表示不同原子:C、H、O、N)

(1)丙烯酰胺的分子式为___,结构简式为___。
(2)有关丙烯酰胺的说法正确的是___。
A.丙烯酰胺分子内所有原子不可能在同一平面内
B.丙烯酰胺属于烃的含氧衍生物
C.丙烯酰胺能够使酸性高锰酸钾溶液褪色
D.丙烯酰胺能够使溴的四氯化碳溶液褪色
(3)工业上生产丙烯酰胺可以用下面的反应(反应均在一定条件下进行):
CH![]() CH
CH![]() CH2=CHCN
CH2=CHCN![]() 丙烯酰胺
丙烯酰胺
假设反应Ⅰ和反应Ⅱ都是原子利用率100%的反应,反应Ⅰ所需另一反应物的分子式为___,反应Ⅱ的方程式为___。
(4)聚丙烯酰胺(PAM)是一种合成有机高分子絮凝剂,写出由丙烯酰胺合成聚丙烯酰胺的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
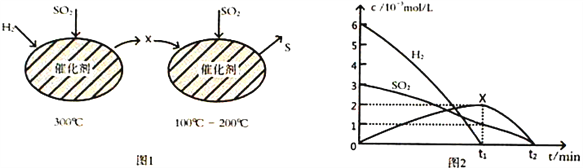
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
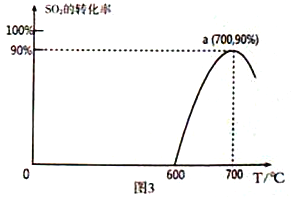
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双缩脲反应可以用于测定蛋白质的含量。双缩脲反应的原理可表示如下:

双缩脲 紫红色配离子
(1)Cu2+的基态核外电子排布式为_______。
(2)与H2O互为等电子体的一种阳离子为_______(填化学式)。
(3)双缩脲分子中氮原子轨道的杂化类型是_______;1 mol双缩脲分子中含有σ键的数目为_______。
(4)该紫红色配离子中的配位原子为_______。
(5)Cu3Au的晶胞如下图所示,Cu3Au晶体中每个铜原子周围距离最近的铜原子数目为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com