
【题目】第VIII族元素单质及其化合物在工业生产和科研领域有重要的用途。
(1)过渡元素Co 基态原子价电子排布式为_____。第四电离能I4 (Co) < I4 (Fe) ,其原因是_________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4的熔、沸点较低的原因为__________。
②写出一种与CO互为等电子体的分子的化学式__________。
③Ni(CO)4中σ键和π键的数目之比为__________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为_______,该离子中杂化轨道的作用是__________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
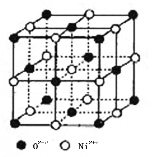
① 镍离子的配位数为__________。
② 若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为__________pm(列出表达式)。
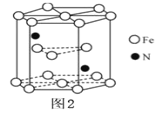
(5)某种磁性氮化铁的结构如图所示,Fe为__________堆积,则该化合物的化学式为__________。 其中铁原子最近的铁原子的个数为__________。
【答案】3d74s2 Fe3+的价电子排布式为3d5,3d轨道处于半充满的稳定结构,不易再失去电子,所以I4 (Fe)>I4 (Co) Ni(CO)4 属于分子晶体,分子间的范德华力容易被破坏 N2 1:1 sp3 形成σ键 6 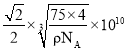 六方最密 Fe3N 12
六方最密 Fe3N 12
【解析】
(1)Co 是27号元素,根据构造原理,可得其基态原子排布式,进而得到其价电子排布式;根据失去电子后形成离子的结构分析;
(2)①根据 Ni(CO)4的熔沸点高低结合各类晶体熔沸点大小分析比较;
②根据等电子体结构相似,性质也相似书写;
③单键都是σ键,三键分子中含有1个σ键和2个π键;
(3)硫酸根中的S原子的价层电子对数是4,其杂化轨道类型为sp3,该离子中的杂化轨道可用于形成σ键;
(4)①根据氯化钠的晶体结构可知镍离子的配位数为6;
②根据氯化钠的晶胞结构可知晶胞中最近的O2-之间的距离为面对角线的一半,根据晶体密度,结合晶胞中含有的粒子数计算晶胞参数可得O2-之间的距离;
(5)由结构可知,Fe为六方最密堆积;图中结构单元中有2个N原子,Fe原子位于结构单元的内部、顶点、面心,注意1个顶点为图中6个结构单元共用,利用均摊法计算图中结构单元中Fe原子数目,进而确定化学式。
(1) Co是27号元素,根据构造原理,可得其基态原子排布式为1s22s22p63s23p63d74s2,过渡元素发生反应时,不仅最外层电子发生变化,次外层电子也发生变化,所以其价电子排布式为3d74s2;Fe是26号元素,Fe失去3个电子后形成的Fe3+电子层结构为3d5,3d轨道处于半充满的稳定结构,不易再失去电子,而Co原子失去4个电子变为Co4+,电子层结构为3d5,3d5是稳定结构,再失去一个电子比较难,所以I4 (Fe)>I4 (Co);
(2)①Ni(CO)4的熔、沸点较低是因为Ni(CO)4 属于分子晶体,分子间以微弱的范德华力结合,范德华力比较微弱,容易被破坏,因此物质的熔沸点比较低;
②CO互为等电子体的分子是N2,N2分子中两个N原子形成三对共用电子对,二者结构相似,因此其结构式C≡O;
③单键都是σ键,三键分子中含有1个σ键和2个π键,Ni(CO)4中σ键和π键的数目之比为8:8=1:1;
②在一个晶胞中含有Ni2+的个数:![]() =4;O2-的个数为:
=4;O2-的个数为:![]() =4,因此在一个晶胞中含有4个NiO;晶胞的质量为m=
=4,因此在一个晶胞中含有4个NiO;晶胞的质量为m=![]() g,晶胞密度为ρ g·cm-3,则晶胞参数为
g,晶胞密度为ρ g·cm-3,则晶胞参数为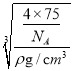 =
=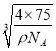 ×1010pm,由于晶胞中最近的O2 -之间的距离为面对角线的一半,所以最近的O2-之间的距离L=
×1010pm,由于晶胞中最近的O2 -之间的距离为面对角线的一半,所以最近的O2-之间的距离L=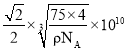 ;
;
(5)由结构可知,Fe为六方最密堆积;图中结构单元中有2个N原子,Fe原子位于结构单元的内部、顶点、面心,注意1个顶点为图中6个结构单元共用,结构单元中Fe原子数目=3+2×![]() +12×
+12×![]() =6,Fe、N原子数目之比为3:1,故该晶体化学式为 Fe3N;面心碳原子与结构单元中6个顶点Fe原子相邻,且与内部3个Fe原子也相邻,密置层为ABAB…方式排列,其中铁原子最近的铁原子的个数为12。
=6,Fe、N原子数目之比为3:1,故该晶体化学式为 Fe3N;面心碳原子与结构单元中6个顶点Fe原子相邻,且与内部3个Fe原子也相邻,密置层为ABAB…方式排列,其中铁原子最近的铁原子的个数为12。


科目:高中化学 来源: 题型:
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,发生反应:
CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) H = - 49.0 kJ·mol-1。
CH3OH(g) + H2O(g) H = - 49.0 kJ·mol-1。
测得H2和CH3OH(g)的浓度随时间变化情况如下图所示:
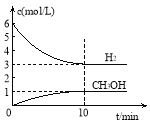
下列说法不正确的是
A.0~10min内v(H2) = 0.3 mol·L-1·min-1
B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等
C.T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
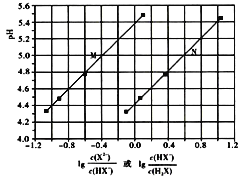
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
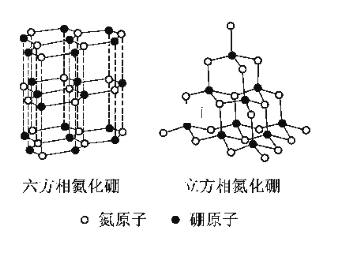
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
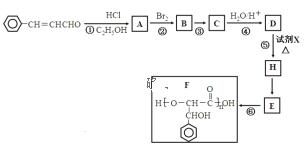
已知:RCHO![]() RCH(OC2H5)2
RCH(OC2H5)2![]() RCHO
RCHO
根据题意回答:
(1)3-苯基丙烯醛分子中官能团的名称为___;
(2)合成路线中的①、④两个步骤的目的是___。
(3)反应③的反应类型为___。
(4)若X为银氨溶液,则反应⑤的化学方程式为___。
(5)同时符合下列条件的D的同分异构体共有___种。
a.既可发生银镜反应又可发生水解
b.能与FeCl3溶液发生显色反应
c.是苯的二元取代物。
上述同分异构体中,核磁共振氢谱有峰面比为1:2:2:2:2:1的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y是阳离子,Z是阴离子,M、N是分子,它们都由短周期元素组成,且具有以下结构特征和性质:
①X、Y、M、N的核外电子总数相等;②常温下,M是极易溶于N的气体;③X与M均由相同的元素组成;④Y为单核离子,其与Z组成的物质可用于净水;⑤Z由同主族元素组成。请回答下列问题:
(1)X的电子式为_______,Z的离子符号为_______。
(2)X与Z形成的化合物中所含有的化学键类型为_______。
(3)写出Y与M、N形成的混合物发生反应的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于右图所示装置(海水为弱碱性)的说法错误的是

A. 若d为石墨,则铁片上的电子反应为:Fe —2e → Fe2+
B. 若d为铜片,则铁片腐蚀加快
C. 若d为锌片,则铁片上的电极反应为:2H+ +2e → H2↑
D. 若d为锌片,则这种保护铁片的方法属于牺牲阳极的阴极保护法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com