
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,发生反应:
CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) H = - 49.0 kJ·mol-1。
CH3OH(g) + H2O(g) H = - 49.0 kJ·mol-1。
测得H2和CH3OH(g)的浓度随时间变化情况如下图所示:
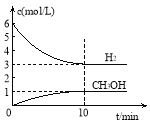
下列说法不正确的是
A.0~10min内v(H2) = 0.3 mol·L-1·min-1
B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等
C.T℃时,当有32 g CH3OH生成时,放出49.0 kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
【答案】D
【解析】
试题分析:A.0~10min内H2的物质的量从6mol减小为3mol,所以v(H2)=(6-3)/10=0.3 mol·L-1·min-1,故正确;B.平衡时c(H2)=3mol/L,c(CO2)=1mol/L,c(CH3OH)=1mol/L,c(H2O)=1mol/L,所以平衡常数K=(1×1)/(1×32)=1/27,CO2和H2的转化率均为50%,故B正确;C.由图可知,平衡时生成1molCH3OH,放出热量为49kJ,32gCH3OH的物质的量为32/32=1mol,所以放出49.0kJ的热量,故正确;D.△H<0,升高温度,平衡逆向移动,H2的转化率减小,而平衡后再充入CO2气体,平衡正向移动,可以提高H2的转化率,故D错误。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
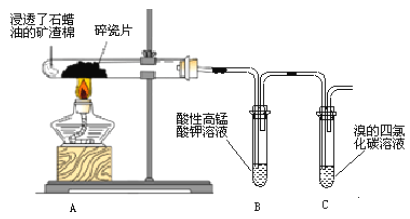
A. 碎瓷片有催化和积蓄热量的作用
B. 结束反应时,先撤出导管,再停止加热
C. 石蜡油是液态烷烃
D. B、C中溶液均褪色,反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学中的反应类型较多,请写出下列反应类型。
①苯与浓硝酸共热生成硝基苯__________
②乙醛和新制的银氨溶液反应__________
③乙烯使溴的四氯化碳溶液褪色________
④溴乙烷和氢氧化钠的乙醇溶液共热________
⑤由乙炔制备聚乙炔_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
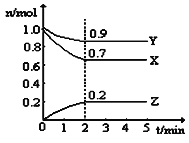
①该反应的化学方程式为__________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填“大”,“小”或“相等”,下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置验证同主族元素非金属性的变化规律。回答下列问题:

(1)仪器A的名称为_______,干燥管D的作用是________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,实验时观察到C溶液中现彖为________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_______吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加______(写化学式)溶液,若观察到C中出现白色沉淀,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新版人民币的发行,引发了人们对有关人民币中化学知识的关注。下列表述不正确的是( )
A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
B. 用于人民币票面文字等处的油墨中所含有的![]() 是一种磁性物质
是一种磁性物质
C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉
D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是______(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1= ____%,反应平衡常数K=_____(保留2位有效数字)。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2____a1,该反应的H___0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为基本原料可制备X、Y、Z、W等物质,下列有关说法中正确的是( )
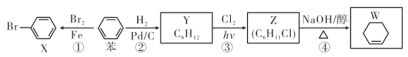
A. 反应①是苯与溴水的取代反应 B. 可用AgN03溶液检测W中是否混有Z
C. X、苯、Y分子中六个碳原子均共平面 D. 反应④中产物除W外还有H2O和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VIII族元素单质及其化合物在工业生产和科研领域有重要的用途。
(1)过渡元素Co 基态原子价电子排布式为_____。第四电离能I4 (Co) < I4 (Fe) ,其原因是_________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4的熔、沸点较低的原因为__________。
②写出一种与CO互为等电子体的分子的化学式__________。
③Ni(CO)4中σ键和π键的数目之比为__________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为_______,该离子中杂化轨道的作用是__________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
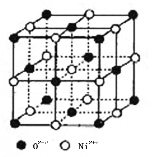
① 镍离子的配位数为__________。
② 若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为__________pm(列出表达式)。
(5)某种磁性氮化铁的结构如图所示,Fe为__________堆积,则该化合物的化学式为__________。 其中铁原子最近的铁原子的个数为__________。
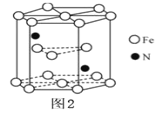
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com