
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
C
解析试题分析:A、由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)= 0.0016mol/(L?s),故A错误;B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)="0.11" mol/L,则n′(PCl3)="0.11" mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B错误;C、对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k= =0.025。
=0.025。
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc= =0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于1.6mol,即相同温度下,起始时向容器中充入2 mol PCl3、和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于1.6mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于80%,故D错误;故选C。
=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于1.6mol,即相同温度下,起始时向容器中充入2 mol PCl3、和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于1.6mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于80%,故D错误;故选C。
考点:本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较麻烦。


科目:高中化学 来源: 题型:单选题
下列关于化学反应的熵变的叙述中,正确的是
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵变为正的反应都是混乱度增大的反应 |
| D.能自发进行的反应熵变一定都为正 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是
Z(g)+W(s) ΔH>0,下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在300℃时,改变起始反应物中n(H2)对反应N2(g) + 3H2(g)  2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
2NH3(g)+Q(Q>0)的影响如右图所示。下列说法正确的是
| A.反应在b点达到平衡 |
| B.b点H2的转化率最高 |
| C.c点N2的转化率最高 |
| D.a、b、c三点的平衡常数Kb > Ka > Kc |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:CO(g)+H2O(g)=CO2(g)+H2(g)△H=﹣41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡过程体系 | |||
| CO | H2O | CO2 | H2 | 能量的变化 | |
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H="74.9" kJ·mol-1,下列说法中正确的是
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) 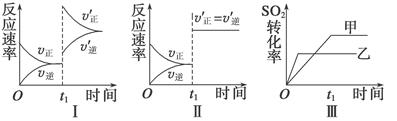
| A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在容积不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
A.该反应的热化学方程式为:N2 + 3H2 2NH3ΔH =-92 kJ/mol 2NH3ΔH =-92 kJ/mol |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.曲线b表示可能使用了催化剂 |
| D.降低温度和缩小容器体积均可使该反应平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
A.10min后,升高温度能使 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com