
【题目】Fe(OH)3 胶体和 MgCl2 溶液共同具有的性质是
A.都是无色透明的溶液
B.分散质粒子都可通过滤纸
C.加入盐酸后都无明显现象
D.都有丁达尔效应
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
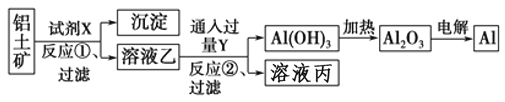
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是将Fe2+氧化为Fe3+ ,其离子方程式________________________,还可使用双氧水代替硝酸,其优点是_________________________________________。
(2)沉淀B的主要成分是_____、_______,往沉淀B中加入足量氢氧化钠溶液,现象是_________,该反应的离子方程式为____________________________________。
(3)加氨水过程需控制溶液的pH值,如何用pH试纸测定溶液的pH值___________。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:2![]() +6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+6H++5H2C2O4=2Mn2++10CO2+8H2O。实验中称取0.800 g水泥样品,滴定时消耗了0.100 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常温下, 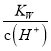 =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF4-离子,则BF3和BF4-中的B原子的杂化轨道类型分别是
A. sp2、sp2B. sp3、sp3C. sp2、sp3D. sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。Na2CO3俗称纯碱,已知25℃时,CO32-第一步水解的平衡常数Kh=2×10-4mol/L,当溶液中c(HCO3-):c(CO32-)=20∶ 1 时,溶液的pH=______。
(2)为了除去银器表面Ag2S,可采用如下方法:在一个铝制的容器中放入食盐溶液,将银器浸入食盐溶液,使银器与铝接触良好形成原电池.过一段时间,银器表面变为银白色,并闻到臭鸡蛋的气味,观察到有少量白色絮状沉淀生成,则原电池的正极反应为______________________________,请解释臭鸡蛋气味形成的原因(用离子方程式表示)________________________________________。

(3)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.040 mol·L-1M2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MS)=5.6×10-17]
(4)Na2S2O3溶液常作为标准液测定物质的组成。
I.取3.92 g某铁的氧化物,溶于足量稀硫酸,并配制成100.0 mL溶液;
II.取10.00 mL所得溶液,加入足量KI溶液,滴加几滴指示剂;
III.用0.2000 mol L-1的Na2S2O3标准溶液滴定,重复2~3次,平均消耗标准液20.00mL。
已知:I2+2S2O32-= S4O62-+2I-。则:
①步骤II 所用指示剂的名称为____________;判断达到滴定终点的操作和现象___________________。
②该铁的氧化物的化学式为______________。
(5)常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如上图,其中三条线代表的是A2-、H2A和HA-浓度变化的曲线,根据图示,当V(NaOH)=20 mL时,溶液中Na+、HA-、 A2-、 H2A四种微粒浓度大小关系:__________________________________。溶液显_______性。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com