
| 催化剂 |
| △ |
氨的平衡 压强(MP)含量% 温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
| 4×10-38 |
| 2×10-13 |
| 6×10-31 |
| 2×10-25 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| +ne- |
| +ne- |
| A、氧化性:A<B |
| B、还原性:An-<Bn- |
| C、稳定性:B<A |
| D、稳定性:An-<Bn- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 储氢 |
| 释氢 |
| A、储氢、释氢过程均无能量变化 |
| B、储氢过程中,NaHCO3被氧化 |
| C、NaHCO3含有离子键和共价键 |
| D、释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )
常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )| A、点②所示溶液中:c(K+)+c(H+)=c(HR-)+c(R2-)+c(OH-) |
| B、点③所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) |
| C、点④所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.04 mol/L |
| D、点⑤所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | ||
B、常温下,
| ||
| C、常温下由水电离出来的c(H+)=1.0×10 -13mol?L-1溶液中:AlO2-、K+、SO42-、Br- | ||
| D、与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂可以使不起反应的物质发生反应 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、可以找到一种催化剂使水变成油 |
| D、催化剂是决定化学反应速率的主要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.查看答案和解析>>
科目:高中化学 来源: 题型:
 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
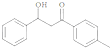 的同分异构体有许多.能与NaHCO3反应,且含有联苯基(
的同分异构体有许多.能与NaHCO3反应,且含有联苯基( 上1个氢原子被取代)的同分异构体共有
上1个氢原子被取代)的同分异构体共有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com