
����Ŀ���Ҵ���һ����Ҫ�Ļ���ԭ�ϣ�����������е�Ӧ�ù㷺��
��1����ҵ�����ö����Ѻϳ��Ҵ�
��Ӧ�٣�CH3OCH3(g) + CO(g)![]() CH3COOCH3(g) ��H1
CH3COOCH3(g) ��H1
��Ӧ�ڣ�CH3COOCH3(g) + 2H2(g)![]() CH3OH(g) + C2H5OH(g) ��H2
CH3OH(g) + C2H5OH(g) ��H2
һ��ѹǿ�£��¶ȶԶ����Ѻ��������ƽ��ת����Ӱ����ͼ��ʾ�����H1
_____________0���������������ͬ������H2_____________0���¶ȶ�ƽ����ϵ����������ĺ������Ҵ�������Ӱ����ͼ��ʾ����300 K��600 K��Χ�ڣ���������İٷֺ��������ӣ��Ҵ��İٷֺ�����С��ԭ����_____________��

��2���Ҵ��������ͣ�ƽ������ʽΪC8H18�����ܸ�����Ʒ���������ٶԻ�����Ӱ����
���Ҵ����Ϳ����ȼ�͵�ȼ��Ч�ʣ�����CO�Ȳ���ȫȼ�ղ�������ɡ���ͬ�����£������ʵ������Ҵ���������ȫȼ����������֮��Ϊ_____________��

��NOx����Ч������Ϊ�����������Ҫ���⡣ij�о�С����ʵ������AgZSM5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�������ͼ��ʾ������ʹ��CO���¶ȳ���775 K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ_____________����![]() =1�������£�Ӧ���Ƶ�����¶���_____________���ҡ�д���������·�����Ӧ�Ļ�ѧ����ʽ��_____________��
=1�������£�Ӧ���Ƶ�����¶���_____________���ҡ�д���������·�����Ӧ�Ļ�ѧ����ʽ��_____________��
��3��ij�Ҵ�ȼ�ϵ�ز������ӣ�H+���ܼ�����200�����ҹ���ĵ���ܷ�ӦΪC2H5OH+3O2 ![]() 2CO2+3H2O���õ�ظ����ĵ缫��ӦʽΪ_____________��
2CO2+3H2O���õ�ظ����ĵ缫��ӦʽΪ_____________��
���𰸡� �� �� 300~600K��Χ�ڣ������¶����ߣ���Ӧ�ٶ�Ӧ��ƽ����ϵ���淴Ӧ�����ƶ��ij̶ȱȷ�Ӧ�ڵ�С 6��25 NO�ֽⷴӦ�Ƿ��ȷ�Ӧ��775Kʱ����Ӧ��ƽ�⣬�����¶Ȳ����ڷ�Ӧ���У����¶ȸ���775Kʱ���������Խ��ͣ� 850 K��900K���ڴ˷�Χ�ڵ���ֵ����ȷ�� 2NO + 2CO![]() N2 + 2CO2 C2H5OH��12e�C + 3H2O �T2CO2 ��+12H+
N2 + 2CO2 C2H5OH��12e�C + 3H2O �T2CO2 ��+12H+
�������������������1����Ӧ�٣�CH3OCH3(g) + CO(g)![]() CH3COOCH3(g) ��H1
CH3COOCH3(g) ��H1
��Ӧ�ڣ�CH3COOCH3(g) + 2H2(g)![]() CH3OH(g) + C2H5OH(g) ��H2
CH3OH(g) + C2H5OH(g) ��H2
һ��ѹǿ�£������¶ȶ����ѵ�ƽ��ת���ʼ�С��˵�����·�Ӧ��ƽ�������ƶ�������Ӧ���ȣ������¶��������ƽ��ת���ʼ�С��˵�����·�Ӧ��ƽ�������ƶ�������Ӧ���ȡ�300~600K��Χ�ڣ������¶����ߣ���Ӧ�ٶ�Ӧ��ƽ����ϵ���淴Ӧ�����ƶ��ij̶ȱȷ�Ӧ�ڵ�С��������������İٷֺ��������ӣ��Ҵ��İٷֺ�����С��
��2���Ҵ��������ͣ�ƽ������ʽΪC8H18�����ܸ�����Ʒ���������ٶԻ�����Ӱ����
����ͬ������1mol�Ҵ���ȫȼ����������3mol��1mol C8H18��ȫȼ����������12.5mol��
��������һ���¶��»�����ߣ�����775Kʱ���������Խ����� NO�ķֽ��ʽ���������ͼʾ����![]() =1�������£��¶�850 K��900KʱNOת���ʽϸߣ�����900Kת���ʱ仯������NO��CO��Ӧ���ɵ����Ͷ�����̼��
=1�������£��¶�850 K��900KʱNOת���ʽϸߣ�����900Kת���ʱ仯������NO��CO��Ӧ���ɵ����Ͷ�����̼��
��3���Ҵ�ȼ�ϵ�ظ������Ҵ�ʧ���ӷ���������Ӧ��
�����������¶ȶ����ѵ�ƽ��ת���ʼ�С��˵������CH3OCH3(g) + CO(g)![]() CH3COOCH3(g)ƽ�������ƶ�������Ӧ���ȡ�H1<0�������¶��������ƽ��ת���ʼ�С��˵������CH3COOCH3(g) + 2H2(g)
CH3COOCH3(g)ƽ�������ƶ�������Ӧ���ȡ�H1<0�������¶��������ƽ��ת���ʼ�С��˵������CH3COOCH3(g) + 2H2(g)![]() CH3OH(g) + C2H5OH(g)ƽ�������ƶ�������Ӧ������H2<0��300~600K��Χ�ڣ������¶����ߣ���Ӧ�ٶ�Ӧ��ƽ����ϵ���淴Ӧ�����ƶ��ij̶ȱȷ�Ӧ�ڵ�С��������������İٷֺ��������ӣ��Ҵ��İٷֺ�����С��
CH3OH(g) + C2H5OH(g)ƽ�������ƶ�������Ӧ������H2<0��300~600K��Χ�ڣ������¶����ߣ���Ӧ�ٶ�Ӧ��ƽ����ϵ���淴Ӧ�����ƶ��ij̶ȱȷ�Ӧ�ڵ�С��������������İٷֺ��������ӣ��Ҵ��İٷֺ�����С��
��2���������Ҵ������͵�ȼ�շ���ʽ����ͬ������1mol�Ҵ���ȫȼ����������3mol��1mol C8H18��ȫȼ����������12.5mol������������Ϊ6��25��
�����ڴ�����һ���¶��»�����ߣ�����ͼʾ������775Kʱ���������Խ���������NO�ķֽ��ʽ��ͣ�����ͼʾ����![]() =1�������£��¶�900KʱNOת���ʽϸߣ�����900Kת���ʱ仯�����������¶ȿ�����900K������NO��CO��Ӧ���ɵ����Ͷ�����̼����Ӧ����ʽΪ2NO + 2CO
=1�������£��¶�900KʱNOת���ʽϸߣ�����900Kת���ʱ仯�����������¶ȿ�����900K������NO��CO��Ӧ���ɵ����Ͷ�����̼����Ӧ����ʽΪ2NO + 2CO![]() N2 + 2CO2 ��
N2 + 2CO2 ��
��3���Ҵ�ȼ�ϵ�ظ������Ҵ�ʧ���ӷ���������Ӧ��������ӦʽΪC2H5OH��12e�C + 3H2O �T2CO2 ��+12H+��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������̼���ƻ�̼�������ܷ���ˮ�����ʵ�ص���
A. ʵ����ʢ��̼������Һ���Լ�ƿ�����������������ò�����
B. ��ĭ�������̼��������Һ����������Һ��ʹ��ʱֻ�轫���ϾͿɲ�������������̼����ĭ
C. �����г���̼������Һϴ�Ӳ;��ϵ�����
D. ����̼�����������ȡ����������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫʯ����Һ�м������Na2O2 ��ĩ�������ɹ۲쵽������Ϊ
A. ��Һ���ձ�Ϊ��ɫ B. ��Һ���ձ�Ϊ��ɫ
C. �����ݲ�������Һ�ȱ���ɫ���Ϊ��ɫ D. �����ݲ�������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
(1)ij��Ԫ��(����ʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2B===H����HB����HB��![]() H����B2������0.1 mol/L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����________��
H����B2������0.1 mol/L��Na2B��Һ�У���������Ũ�ȹ�ϵʽ��ȷ����________��
A��c(B2��)��c(HB��)��0.1 mol/L
B��c(B2��)��c(HB��)��c(H2B)��![]() c(Na��)
c(Na��)
C��c(OH��)��c(H��)��c(HB��)
D��c(Na��)��c(OH��)��c(H��)��c(HB��)
(2)�±�Ϊ������ĵ���ƽ�ⳣ��
CH3COOH | H2CO3 | H2S |
1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | K1��9.1��10��8 K2��1.1��10��12 |
��pH��ͬ��CH3COONa��Na2CO3��NaHS��Һ���ʵ���Ũ���ɴ�С��˳��Ϊ________________������CO2��NaHS��Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��H2�ڴ����������ºϳɼ״����������·�Ӧ��CO(g)��2H2(g) ![]() CH3OH(g)�������һ�����ܱ������а����ʵ���֮��1��2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯�������ͼ��ʾ�����н�����ȷ����
CH3OH(g)�������һ�����ܱ������а����ʵ���֮��1��2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯�������ͼ��ʾ�����н�����ȷ����

A. �÷�Ӧ����H>0 B. ƽ�ⳣ����K(C)< K(D)
C. ѹǿ��p1>p2 D. �ﵽƽ��ʱ����Ӧ������v(A)> v(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ�����ȷ����
A.��������������Һ�����ڽ���B.H2O��CO2��Ϊ�����
C.NO��SO3��Ϊ����������D.H2S��O2������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F�Ǻϳɽ�Ѫ֬ҩ�ﰢ����͡����Ҫ�м��壬��ϳ�·�����£�

��1��������D�еĺ���������Ϊ��������_____________��_____________������������ƣ���
��2����Ӧ�١����У�����ȡ����Ӧ����_____________������ţ���
��3���˺ϳ�·����F�IJ��ʲ��ߣ�ԭ���Ƿ�Ӧ���л���һ�ֺ�B��Ϊͬ���칹��ĸ��������ɣ���ṹ��ʽΪ_____________��
��4��д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��_____________��
I�������к���һ������5Ԫ����II����ʹ��ˮ��ɫ��
III���˴Ź���������ʾ��ԭ�ӵķ�ֵ��Ϊ1�U1�U2�U3��
��5������CH3COOC2H5��HCHOΪԭ���Ʊ�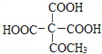 ��д����Ӧ�ĺϳ�·������ͼ________�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
��д����Ӧ�ĺϳ�·������ͼ________�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Ϊ�ҹ�������������ȫ���Ļ�������֮һ��
������β���ǿ�����Ⱦ����Ҫԭ������β������ԭ��Ϊ��
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H <0��
2CO2(g)+N2(g) ��H <0��
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ____________________��
(2)��һ���ݵľ�������(������緢���Ƚ���)��ģ��������Ӧ�������ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴ﵽƽ��״̬����__________��

��úȼ�ղ����������к��д���������������������صĻ�����Ⱦ���⡣
(1) ���������ﶼ���γ����ꡣΪ����������������д�ʩ�в����е���_______(�����)��
a.����ú��ȼ�ϡ� b.�ѹ������̴ѼӸߡ� c.ȼ������
d.ȼúʱ������������ e.��������Դ
(2)úȼ�ղ����ĵ��������������CH4����ԭ����֪��
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) ��H =��867kJ/mol
2NO2(g) = N2O4(g) ��H =��56.9kJ/mol
H2O(l) = H2O(g) ��H =+44kJ/mol
д��CH4(g) ��ԭN2O4(g)����N2(g) ��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ������ڿ�����Ѹ�ٱ���������ɫ��������ֽ⣬��ɺ�ɫ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ(��Fe3����Cu2����Fe2����Cl��)����CuCl�����̣�

����������Ϣ�ش��������⣺
��1�������������X___________��Y___________��
��2��д������CuCl�Ļ�ѧ����ʽ��______________________��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵�����ɣ�________��
��4����CuCl�����ɹ����г��������⡢��ȫ�����⣬����Ϊ��Ӧ��ע��Ĺؼ�������______________��
��5��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl���� | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ___________����pH�ϴ�ʱCuCl���ʱ�͵�ԭ����________________��
��6���Ȼ���ͭ�Ķ���������
����ȡ��Ʒ0.25 g��10 mL������FeCl3��Һ��250 mL��ƿ�У�����ܽ⡣
����0.10 mol��L��1������[Ce(SO4)2]����Һ�ζ�����֪��CuCl �� FeCl3 === CuCl2 �� FeCl2 ��Fe2�� �� Ce4�� === Fe3���� Ce3��������ƽ��ʵ��������(ƽ��ʵ�������ܳ���1%)��
ƽ��ʵ����� | 1 | 2 | 3 |
0.25 g��Ʒ�������������Һ�����(mL) | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ___________(���������λ��Ч����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com