
【题目】在室温下,下列说法正确的是![]()
![]()
A.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
B.同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]()
C.有两种酸HA和HB,已知HA的酸性比HB弱,在物质的量浓度均为![]() 的NaA和NaB混合溶液中,有
的NaA和NaB混合溶液中,有![]()
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液,其浓度大小关系为:
溶液、NaOH溶液,其浓度大小关系为:![]()
【答案】B
【解析】
A.酚酞的变色范围是8~10,所以在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,说明此时溶液的pH<8,A错误;
至溶液恰好无色,说明此时溶液的pH<8,A错误;
B.![]() 和
和![]() 相互抑制水解,
相互抑制水解,![]() 促进
促进![]() 水解,氯离子对
水解,氯离子对![]() 水解无影响,一水合氨是弱碱,在溶液中存在微弱的电离平衡,
水解无影响,一水合氨是弱碱,在溶液中存在微弱的电离平衡,![]() 是强电解质,在水溶液中完全电离,
是强电解质,在水溶液中完全电离,![]() 是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中
是弱电解质,在水溶液中部分电离,相同浓度的这几种溶液中一水合氨中![]() 最小,所以同
最小,所以同![]() 的溶液:
的溶液:![]() 溶液,物质的量浓度最大的是
溶液,物质的量浓度最大的是![]() ,B正确;
,B正确;
C.HA的酸性比HB弱,则相同浓度的HB的电离程度大于HA,酸的电离程度越大,其酸根离子的水解能力越小,所以![]() 的水解能力大于
的水解能力大于![]() ,c(B-)>c(A-),c(HA)>c(HB);OH-又因A-、B-水解产生和水电离产生,则c(OH-)>c(HA),所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中微粒浓度大小顺序为:c(Na+)>c(B-)>c(A-)> c(OH-)>c(HA)>c(HB)>c(H+) ,C错误;
,c(B-)>c(A-),c(HA)>c(HB);OH-又因A-、B-水解产生和水电离产生,则c(OH-)>c(HA),所以在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中微粒浓度大小顺序为:c(Na+)>c(B-)>c(A-)> c(OH-)>c(HA)>c(HB)>c(H+) ,C错误;
D.pH相同的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液、NaOH溶液中,c(OH-):碱电离大于盐的水解,且形成盐的酸的酸性越弱,盐水解程度越大,当溶液pH相等时,盐的浓度越小。氢氧化钠溶液为强碱,其浓度最小;酸性:CH3COOH>C6H5OH>NaHCO3,水解程度碳酸钠最大、醋酸钠最小,则pH相同时盐的浓度大小为:
溶液、NaOH溶液中,c(OH-):碱电离大于盐的水解,且形成盐的酸的酸性越弱,盐水解程度越大,当溶液pH相等时,盐的浓度越小。氢氧化钠溶液为强碱,其浓度最小;酸性:CH3COOH>C6H5OH>NaHCO3,水解程度碳酸钠最大、醋酸钠最小,则pH相同时盐的浓度大小为:![]() ,所以四种物质的浓度关系为:
,所以四种物质的浓度关系为:![]() ,D错误;
,D错误;
故合理选项是B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】为了缓解温空效应,科学家提出了多种回收和利用![]() 的方案。
的方案。
![]() 方案1:利用FeO吸收
方案1:利用FeO吸收![]() 获得
获得![]()
![]()
![]()
则![]() ______。
______。
方案2:利用![]() 制备
制备![]()
![]() 时,向2L恒容密闭容器中充入
时,向2L恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,混合气体中
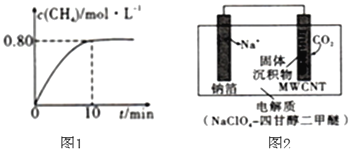
,混合气体中![]() 的浓度与反应时间的关系如图1所示。
的浓度与反应时间的关系如图1所示。
![]() ①从反应开始到恰好达到平衡时,
①从反应开始到恰好达到平衡时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。
②![]() 时,反应的平衡常数
时,反应的平衡常数![]() ______。
______。
③保持温度不变,向平衡后的容器中再充入![]() 和
和![]() ,重新达到平衡时
,重新达到平衡时![]() 的浓度______
的浓度______![]() 填序号
填序号![]() 。
。
A.等于![]()
![]() 等于
等于![]()
![]()
![]() 大于
大于![]()
![]() 时,如果该容器中有
时,如果该容器中有![]() 、
、![]() 、
、![]() 、
、![]() 。则
。则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() “
“![]() 。
。
![]() 已知:
已知:![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() 则
则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
方案3:利用“![]() ”电池将
”电池将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池以钠箔和多壁碳纳米管
”电池以钠箔和多壁碳纳米管![]() 为电极材料,总反应为
为电极材料,总反应为![]()
![]()
![]() 放电时该电池“吸入”
放电时该电池“吸入”![]() ,其工作原理如图2所示:
,其工作原理如图2所示:![]() 假设开始时两极的质量相等
假设开始时两极的质量相等![]()
![]() ①放电时,正极的电极反应式为______。
①放电时,正极的电极反应式为______。
②若生成的![]() 和C全部沉积在电极表面,当转移
和C全部沉积在电极表面,当转移![]() 时,两极的质量差为______g。
时,两极的质量差为______g。
![]() 室温下,物质的量浓度均为
室温下,物质的量浓度均为![]() 的几种含碳盐溶液的pH如下表:
的几种含碳盐溶液的pH如下表:
序号 | ① | ② | ③ |
溶液 |
| NaX |
|
pH |
|
|
|
写出溶液②中通入少量![]() 的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是______(填“吸热”或“放热”)反应。
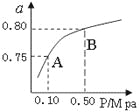
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H______0; △S______0(填“>”“=”或“<”)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正)______v(逆)(填“>”“=”或“<”)
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是___________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是__________________。
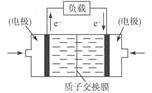
(5)甲醇燃料电池通常采用铂电极,其工作原理如图所示,负极的电极反应为:______________________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的醋酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液的说法不正确的是 ![]()
A.加水稀释![]() 溶液过程中,水电离出的
溶液过程中,水电离出的![]() 逐渐减小
逐渐减小
B.![]() 的
的![]() 溶液,用蒸馏水稀释10倍后,溶液的
溶液,用蒸馏水稀释10倍后,溶液的![]()
C.![]() 的一元酸HA溶液与
的一元酸HA溶液与![]() 的NaOH溶液等体积混合后,
的NaOH溶液等体积混合后,![]()
D.pH相同的![]()
![]()
![]() 三种溶液中
三种溶液中![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为 SO2 具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.向 50 mL 18.4 mol/L H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的 H2SO4的物质的量小于 0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于 5.6
D.浓 HNO3 与浓盐酸按 3∶1 的体积比混合所得的混合物叫王水,能溶解金和铂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)建立沼气池可实现如图能量转化:___、___(在框内填写能量的形式)。
![]()
(2)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水溶液中的离子平衡,下列说法正确的是
A.往![]() 稀溶液中加入NaOH固体,溶液中
稀溶液中加入NaOH固体,溶液中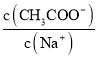 变大
变大
B.等物质的量浓度的![]() 、
、![]() 、
、![]() 三种溶液中,
三种溶液中,![]() 的大小顺序为:
的大小顺序为:![]()
C.常温下![]() 的
的![]() 溶液和
溶液和![]() 的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:
的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:![]()
D.![]() 的
的![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨![]() 的水溶液中有:
的水溶液中有:
![]()
![]()
![]()
![]() 提示:二元弱碱的电离也是分步电离
提示:二元弱碱的电离也是分步电离![]()
该溶液中的微粒的物质的量分数![]() 随
随![]() 变化的关系如图所示。下列叙述错误的是
变化的关系如图所示。下列叙述错误的是![]()
![]()
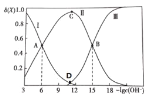
A.据A点可求:![]()
B.D点溶液的 ![]()
C.若C点为![]() 溶液,则存在:
溶液,则存在:![]()
D.在![]() 水溶液中,
水溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸![]() 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是![]()
![]()
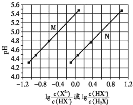
A.![]() 的数量级为
的数量级为![]()
B.曲线N表示pH与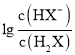 的变化关系
的变化关系
C.NaHX溶液中![]()
D.当混合溶液呈中性时,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com