
【题目】(1)工业上生产纯硅的工艺流程如下:
![]()
①石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”),生成气体的化学式为________;在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性液体杂质(与液态四氯化硅互溶),必须分离提纯。其提纯方法为____(填字母)。
A. 蒸馏 B. 过滤 C. 萃取 D. 蒸发
(2)向硫酸亚铁溶液中滴加氢氧化钠溶液,看到的现象是____________________,写出沉淀变化的化学方程式 ________________________________。
(3)把10.2 g镁铝合金的粉末放入500mL过量的稀盐酸中,得到11.2 L H2(标准状况下)求:①该合金中镁的质量为__________。
②反应后所得溶液中Al3+的物质的量浓度为__________ (假设反应前后溶液体积不变)。
【答案】还原剂 CO 1.204×1023 A 白色絮状沉淀迅速变成灰绿色,最后变为红褐色 4Fe(OH)2+O2 +2H2O=4Fe(OH)3 4.8g 0.4mol·L-1
【解析】
(1)二氧化硅和焦炭在高温下反应生成粗硅和CO,生成的粗硅和氯气化合生成四氯化硅,四氯化硅和氢气发生置换反应生成生成硅和氯化氢,据此解答。
(2)硫酸亚铁和氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定易被氧化,据此解答。
(3)镁铝均能与盐酸反应产生氢气,根据金属的质量和产生的氢气体积结合方程式计算。
(1)①石英砂的主要成分是SiO2,二氧化硅和焦炭在高温下反应生成粗硅和一氧化碳,碳元素化合价升高,失去电子,因此在制备粗硅时,焦炭的作用是还原剂,生成气体的化学式为CO;在该反应中,硅元素化合价从+4价降低到0价得到4个电子,若消耗了3.0 g SiO2,二氧化硅的物质的量是3.0g÷60g/mol=0.05mol,则转移电子的物质的量是0.05mol×4=0.2mol,电子总数为0.2mol×6.02×1023/mol=1.204×1023。
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性液体杂质(与液态四氯化硅互溶),必须分离提纯,由于二者的沸点相差较大,则其提纯方法为蒸馏法,答案选A。
(2)硫酸亚铁和氢氧化钠溶液发生复分解反应反应生成硫酸钠和氢氧化亚铁,氢氧化亚铁不稳定易被氧化,因此看到的现象是白色絮状沉淀迅速变成灰绿色,最后变为红褐色,沉淀变化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)标况下11.2L氢气的物质的量是11.2L÷22.4L/mol=0.5mol,设合金中镁和铝的物质的量分别是xmol、ymol,则24x+27y=10.2。根据方程式Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑可知x+1.5y=0.5,解得x=0.2、y=0.2。
①该合金中镁的质量为0.2mol×24g/mol=4.8g。
②根据铝原子守恒可知反应后所得溶液中Al3+的物质的量浓度为0.2mol÷0.5L=0.4mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A. HSO3-的水解离子方程:HSO3-+H2O![]() H3O++SO3
H3O++SO3
B. 以银为电极电解硫酸铜溶液离子方程式:Cu2++2H2O = 2Cu+4H+ +O2↑(电解条件)
C. 向FeI2溶液中通入一定量Cl2的离子方程式可能为:2Fe2++2Cl2 +2I-= 2Fe3++4Cl-+I2
D. 乙烯的燃烧热是akJ/mol,表示乙烯燃烧热的热化学方程式为:C2H4(g)+3O2(g) =2CO2(g)+2H2O(l) △H=-akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在水中不稳定,发生反应:4FeO![]() +10H2O
+10H2O ![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是:
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是:

图Ⅰ K2FeO4的稳定性与温度关系 图Ⅱ K2FeO4的稳定性与溶液pH关系
A.由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B.由图Ⅰ可知温度:T1>T2>T3
C.由图Ⅰ可知上述反应ΔH < 0
D.由图Ⅱ可知图中a < c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象的预测不正确或实验设计不能达到实验目的的是

A. 实验I:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
B. 实验II:倒转振荡后正立静置,下层液体为紫红色
C. 实验III:比较NaHCO3和Na2CO3的热稳定性
D. 实验IV:制备Fe(OH)2并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各組离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-、
B. c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
C. c(Fe3+) =lmol/L的溶液中:Na+、NH4+、A1O2-、SO42-
D. 能使甲基橙变紅的溶液中: K+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,褪色 | 有乙烯生成 |
B | 向试管中的浓硫酸加入铜片,盖好胶塞,导管通气入品红溶液,无明显现象 | 铜片未打磨 |
C | 除去CuSO4溶液中Fe2+:先加足量H2O2,再加Cu(OH)2调溶液pH=4 | Ksp[Cu(OH)2]>Ksp[Fe(OH)2] |
D | 将有色纸条放入盛满干燥氯气的集气瓶中,盖上玻璃片,无明显现象 | 氯气漂白不是Cl2分子直接作用的结果 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:
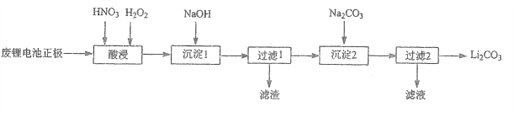
(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是____________。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式___________________。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是____________。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_______________________。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是__________。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH];向Mn(OH)2中边搅拌边加入_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化台物J是一种重要的有机中间体,可以由苯合成:
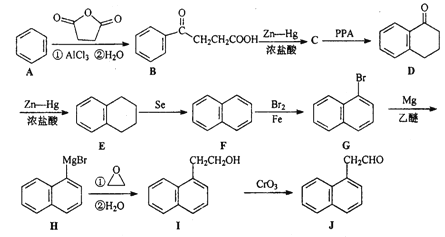
(1) B中含氧官能团名称为_________
(2) D![]() E的反应类型为_____________
E的反应类型为_____________
(3) C的分子式为C10H12O2,经取代反应得到D;写出C的结构简式_________。
(4)写出同时满足下列条件的J的一种同分异构体的结构简式______________
①属于芳香族化合物;②不能与金属钠反应;③有3种不同化学环境的氢原子。
(5)已知: 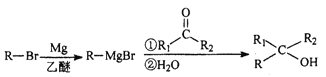 (R表示烃基,R1、R2表示氢或烃基)。
(R表示烃基,R1、R2表示氢或烃基)。
请写出以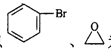 为原料制备
为原料制备![]() 的合成路线图。
的合成路线图。
(无机试剂任用,合成路线流程图示例见本题题干)。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com