
NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO 数为0.1NA
数为0.1NA
A.②④⑤ B.①③⑤
C.①②④⑤ D.①②③
解析】 ①用铜作电极电解饱和氯化钠溶液,阳极是铜失电子转化成Cu2+,阳极得不到氯气,错误;②16 g O2的物质的量为0.5 mol,含氧原子数为NA,16 g O3的物质的量为1/3 mol,含氧原子数为NA,正确;③在标准状况下,乙醇为液体,不能运用标准状况下的气体摩尔体积计算,错误;④6.5 g锌的物质的量为0.1 mol,完全反应失去电子0.2 mol,由H2SO4~SO2、H2SO4~H2可知,生成1 mol SO2或1 mol H2都需要转移2 mol e-,所以气体分子总数为0.1NA,正确;⑤Na2CO3是离子化合物,固体中含有钠离子和碳酸根离子,10.6 g Na2CO3的物质的量为0.1 mol,含碳酸根离子数为0.1NA,正确。综上所述,A正确。
【答案】 A


科目:高中化学 来源: 题型:
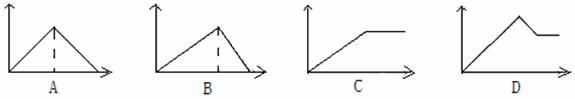
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
环己酮是一种重要的化工原料,已知实验室制备环己酮的原理为 。现用如图装置制备环己酮(部分夹持仪器未画出):
。现用如图装置制备环己酮(部分夹持仪器未画出):

合成装置 精制装置
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 微溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多。实验时,先在合成装置中加入5.0mL环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液。酸性Na2Cr2O7溶液的加料方式为_________(填字母)。
A.一次性加入 B.缓慢加入 C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35mL,则应选取____________(填“100mL”或“250mL”)的三颈瓶。
(3)回流两小时反应完成后,加入适量水,换上冷凝收集装置后蒸馏,收集95~100℃的馏分A,其主要成分是____________的混合物。
(4)合成装置中冷凝管的作用是_________________,冷凝水从冷凝管的______(填“a”或“b”)口进入。
(5)在馏分A中加入氯化钠固体至饱和,静置、分液,得有机层B。加入氯化钠固体的作用是________________________________。
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分。过滤,将滤液置于精制装置中蒸馏,收集____________(填字母)的馏分,得到纯净的环己酮。
A.100.0~102.0℃ B.154.0~156.0℃ C.160.0~162.0℃
(7)精制装置中的两处错误分别是:_________________、______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列每组分别给出了两个量,其中可以求出物质的量的有
( )。
| ① | ② | ③ | ④ | ⑤ |
| 物质所含的微粒数 | 固体体积 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A.①②⑤ B.②③④ C.①④⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100 mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为________。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为________mol。
(3)如果盐酸过量,生成CO2的体积为________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道__________ _______________________________________________。
_______________________________________________。
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH—→CH2===CH2↑+H2O。已知CH2===CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2===CH2(g)生成1 mol液态水的ΔH为( )
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-2 777.8 kJ·mol-1
D.+2 777.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是 ( )
A.元素原子核外电子层排布呈周期性变化 B.元素相对原子质量依次递增
C.元素原子半径大小呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | –1 | –2 | +4 –4 | –1 | +5 –3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A.A的单质能将E单质从KE的溶液中置换出来
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质不存在同素异形体
D.J在DB2中燃烧生成两种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,0.1 mol/L HA的pH=4,下列叙述正确的是
A.水电离出的c(H+)为1.0×10-4 mol/L
B.升高温度pH不变
C.向溶液中加少量水,c(H+)增大
D.NaA溶液显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com