
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH—→CH2===CH2↑+H2O。已知CH2===CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2===CH2(g)生成1 mol液态水的ΔH为( )
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-2 777.8 kJ·mol-1
D.+2 777.8 kJ·mol-1
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
从海水中提取镁的工艺流程可表示如下:
 贝壳
贝壳 石灰乳
石灰乳
海水 母液
母液 Mg(OH)2
Mg(OH)2
MgCl2·6H2O MgCl2
MgCl2 Mg
Mg
下列说法不正确的是 ( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为________。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为________。
(2)(2014届江西师大附中期末)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________
②所得溶液中Cl-的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO 数为0.1NA
数为0.1NA
A.②④⑤ B.①③⑤
C.①②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
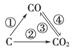
(1)右图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)CH3OH(g)
方法二 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)===4Ag(s)+O2(g)
ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,全球每年发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应
式中,能表示铁的电化学腐蚀的是 ( )
① Fe-2e-=Fe2+ ② 2H++2e-=H2↑ ③ Fe-3e-=Fe3+
④ 2H2O+O2+4e-=4OH- ⑤ 4OH--4e-=2H2O+O2↑
A.①②⑤ B.②③④ C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
右图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
⑴A为 (填“原电池”或“电解池”),其中Ag电极的电极反应式为: ;
发生 反应(填“氧化”或“还原”)。
⑵B装置中的电极b极为 极,电极反应式为 ,
总反应的化学方程式为 。
⑶工作一段时间后,当Zn片质量减少6.5g时,a极逸出的气体在标准状况下的体积 L。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种元素原子序数依次增大,它们的结构、性质信息如下表:
| 元素 | 结构、性质信息 |
| X | 最外层电子数等于次外层电子数 |
| Y | 单质在常温下是固体,基态原子的M层上有1个未成对的p电子 |
| Z | 元素正三价离子的3d能级为半充满 |
| W | 元素基态原子的M层全充满,N层只有一个电子 |
(1)元素Y的原子核外共有 种不同运动状态的电子。
(2)Z元素基态原子的价电子排布式 。
(3)以上四种元素的单质中可与NaOH溶液反应的是 。(填元素符号)
(4)向WSO4溶液中逐渐滴加氨水,观察到 ,
相关的离子方程式 。
(5)灼烧铜丝时会产生绿色火焰,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com