
以下是对金属及其化合物的讨论,根据要求回答问题
(1)写出钠与水反应的离子方程式 。
(2)在AlCl3溶液中逐滴滴入过量的NaOH溶液,观察到的现象是 ,
反应的离子方程式为 , 。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为 。
(1)2Na+2H2O=2Na++2OH-+H2↑ (2)先沉淀后溶解,Al3++3OH-=3Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O (3)1:1
解析试题分析:(1)书写离子方程式时,只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包括难溶强电解质)一律写成分子形式。则得出离子方程式为2Na+2H2O=2Na++2OH-+H2↑。(2)在AlCl3溶液中逐滴滴入NaOH溶液,先发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成白色的Al(OH)3沉淀,随着NaOH溶液滴加过量,则生成的Al(OH)3与过量的NaOH反应生成NaAlO2,反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,沉淀又溶解。根据离子方程式书写规则得反应的离子方程式为Al3++3OH-=3Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O (3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,而Al反应产生H2实质上是电子的转移,Al失电子,H+得电子变为H2,在相同状况下产生氢气的量相同,则由得失电子守恒知,消耗铝的物质的量也相同,因此,两个反应中消耗的铝的物质的量之比为1:1。
考点:考查离子方程式的书写以及得失电子守恒原理。


科目:高中化学 来源: 题型:填空题
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是____________________________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。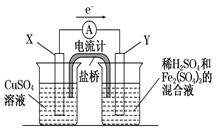
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: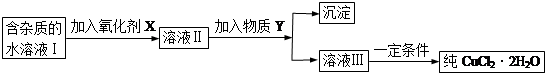

已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺的流程如下: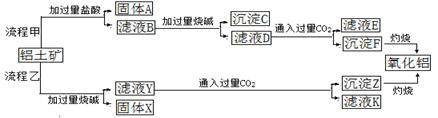
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为____________________________.
(2)流程乙加入烧碱后生成SiO32—的离子方程式为______________________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是____________(填化学式),写出该溶液的一种用途____________
(5)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10—12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关物质间转化关系如下图,试回答:
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)写出制备G的化学反应方程式。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。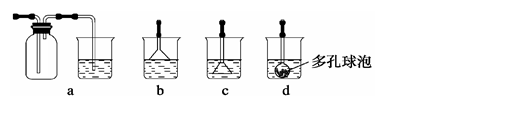
(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题: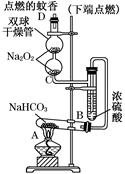
(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是__________________________________。
(3)在双球干燥管内发生反应的化学方程式为_______________。
(4)双球干燥管内观察到的实验现象是__________________________
____________________________________________________________________。
上述实验现象说明________________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式 ;
(2)n(Mg2+)/ n(Al3+) = ;
(3)C1/C2= ;
(4)所加入NaOH溶液的体积a= mL。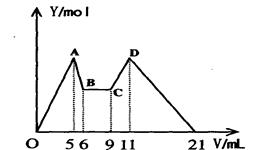
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com