
����Ŀ������X��Y��Z����Ԫ�أ���֪��
�� X��Y��Z�ĵ����ڳ����¾�Ϊ���塣
�� X�ĵ�����Z�ĵ�����ȼ�գ�����XZ ��ȼ��ʱ����Ϊ��ɫ��
�� XZ��ˮ��Һ��ʹ��ɫʯ����Һ��졣
�� ������X�ĵ�����һ����Y�ĵ��ʻ��ϣ�����������X2Y��X2Y������ΪҺ�塣
�� Z�ĵ�������X2Y�У�������Һ����Ư���ԡ�
�ݴ��ƶϣ�
��1�� X__________��Y____________��Z___________ (дԪ�ط���)��
��2��д���ݵķ�Ӧ����ʽ________________________________________ .
��3��Z�ĵ��ʹ�ҵ�Ʒ��Ļ�ѧ����ʽ��___________________________ .
���𰸡�H O Cl Cl2 + H2O ![]() HCl + HClO 2NaCl +2 H2O
HCl + HClO 2NaCl +2 H2O ![]() 2NaOH + H2 ��+ Cl2��
2NaOH + H2 ��+ Cl2��
��������
X��Y��Z�ĵ����ڳ����¾�Ϊ���壬X�ĵ�����Z�ĵ�����ȼ�գ�����XZ��ȼ��ʱ����Ϊ��ɫ����������������ȼ�յ�����XZ��ˮ��Һ��ʹ��ɫʯ����Һ��죬˵��XZ��HCl��������X�ĵ�����һ����Y�ĵ��ʻ��ϣ�����������X2Y��X2Y������ΪҺ�壬Z�ĵ��ʼ�Cl2������X2Y�У�������Һ����Ư���ԣ�˵��X2Y��H2O��
��1����������������֪��XΪH��YΪO��Z ΪCl��
��2��Cl2����ˮ����HCl��HClO�� ����ʽΪ��Cl2 + H2O ![]() HCl + HClO��
HCl + HClO��
��3��Cl2�Ĺ�ҵ�Ʒ��ǵ�ⱥ��ʳ��ˮ������NaOH��H2��Cl2����Ӧ����ʽΪ��2NaCl +2 H2O ![]() 2NaOH + H2 ��+ Cl2����
2NaOH + H2 ��+ Cl2����


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӣ������˹�ش�ѧ��ѧ�Ұ����ҡ���ķ�Ϳ�˹̹����ŵ��Ф���ͬ��������Ķ�����ͻ���Եء���˺�ѵķ����ɹ���ó�������ʯīϩ�����Ʊ�ʯīϩ������ʯī���뷨����ѧ����������ȡ�ʯīϩ�����ģ��ʾ��ͼ���£�

��1�������й�ʯīϩ˵����ȷ����________________��
A��������ʯīϩ>���ʯ
B��ʯīϩ����������ԭ�ӿ��Դ���ͬһƽ��
C��12gʯīϩ��![]() ����ΪNA
����ΪNA
D����ʯī�����ʯīϩ��˷�ʯī�����֮��ķ��Ӽ�������
��2����ѧ����������ǻ�ô���ʯīϩ����Ч����֮һ������Ϊ��ͭ���ܵȽ�����Ͻ𣬺�̼Դ�����Ǽ��顢��Ȳ�������Ҵ���̪ݼ���е�һ�ֻ�������ϡ�
��ͭԭ���ڻ�̬ʱ�����е��������ܼ��У�������ߵ��ܼ�����Ϊ_____________����������Ԫ���У�������������ͭ��ͬ��Ԫ�ػ���________________________��
���Ҵ��ķе�Ҫ������Է��������������ߵĶ��飬�����ԭ��______________________________��
�����з������ڷǼ��Է��ӵ���__________________��
a������ b�����ȼ��� c���� d���Ҵ�
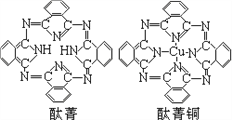
��̪ݼ��̪ݼͭȾ�Ϸ��ӽṹ��ͼ��̪ݼ������̼ԭ�Ӳ��õ��ӻ���ʽ��__________��̪ݼͭ��������ԭ�ӵ���λ��Ϊ________________��
�ݽ���ͭ���γɵĽ���������Ͻ���ͼ���þ����У�Auռ���������8�����㣩��

���Ļ�ѧʽ�ɱ�ʾΪ_____����Au��Χ�����������ȵ�Cu��_____������2��Cuԭ�Ӻ˵���С����Ϊd pm���þ�����ܶȿ��Ա�ʾΪ___________________g/cm3��������٤��������NA��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڡ�ʵ���ҴӺ�������ȡ����������£�
����![]() �����
�����![]() ���������Һ
���������Һ![]()

��1��д����ȡ��Ĺ������й�ʵ����������ƣ���______����________��
��2����ȡ��Ĺ����пɹ�ѡ����л��ܼ�����____��
A�����͡��ƾ� B�����Ȼ�̼������ C�����ᡢ�ƾ�
��3��Ϊ������Ϣ���������������ʵ���������ձ���������������̨����ƿ�����ܡ��ƾ��ƣ���ȱ�ٵIJ���������____________________________________��
��4���Ӻ�����л��ܼ�����ȡ��ͻ����л��ܼ�������Ҫ��������ָ����ͼ��ʾ��ʵ��װ���еĴ���֮������______����________����________����________��

��5��Ϊ���ڿ�������ʱ���¶ȣ�����ʱʹ��ˮԡ���ȣ���������________��ۼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����Ӽ������ۼ�����������ȷ����
A.���ӻ�������ֻ�������Ӽ���û�й��ۼ�
B.�Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ�����
C.���ۻ����������һ�����������Ӽ�
D.���ɷǽ���Ԫ����ɵĻ�������һ���������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������2molL��1��Na2CO3��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡNa2CO3�������ֱ��ǣ� ��
A.1000mL��212g
B.950mL��543.4g
C.1000mL��201.4g
D.500mL��286g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհס�
(1)�ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��______________��ֱ�������һ���������Һ��________ɫ��Ϊ________ɫ����________Ϊֹ��
(2)���в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���__________��
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B���ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ_______mL���յ����Ϊ_______mL������������Һ�����Ϊ_______mL��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO(g)��H2O(g)��Ӧ���̵������仯��ͼ��ʾ���й����߷�Ӧ��˵������ȷ����

A. �÷�ӦΪ���ȷ�Ӧ
B. CO(g)��H2O(g)���������������CO2(g)��H2(g)�����������
C. ��Ӧ���Ȼ�ѧ����ʽ��CO(g)+H2O(g)�TCO2(g)+H2(g) ��H=+41 kJmol��1
D. 1 mol CO2(g)��1 mol H2(g)��Ӧ����1 mol CO(g)��1 mol H2O(g)Ҫ�ų�41 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��HXϡ��Һ��ij��YOHϡ��Һ�����ʵ���Ũ����ȣ�����Һ��Ϻ���Һ��pH����7���±����жϺ�������(����)
��� | HX | YOH | ��Һ�������ϵ |
�� | ǿ�� | ǿ�� | V(HX)��V(YOH) |
�� | ǿ�� | ǿ�� | V(HX)��V(YOH) |
�� | ǿ�� | ���� | V(HX)��V(YOH) |
�� | ���� | ǿ�� | V(HX)��V(YOH) |
A. �٢� B. �ڢ�
C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ�������
��1��T1��ʱ����2L�ܱ������г���0.6molSO3��ͼ1��ʾSO3���ʵ�����ʱ��ı仯���ߡ�

��ƽ��ʱ��SO3��ת����Ϊ______������һλС��������T1���·�Ӧ2SO2(g)+O2(g) ![]() 2SO3(g) ��ƽ�ⳣ��Ϊ____________���������������䣬��8minʱѹ�������������1L����n(SO3)�ı仯����Ϊ_______������ĸ����
2SO3(g) ��ƽ�ⳣ��Ϊ____________���������������䣬��8minʱѹ�������������1L����n(SO3)�ı仯����Ϊ_______������ĸ����
���±�Ϊ��ͬ�¶�(T)�·�Ӧ2SO2(g)+O2(g) ![]() 2SO3(g) ��H��0�Ļ�ѧƽ�ⳣ����K����
2SO3(g) ��H��0�Ļ�ѧƽ�ⳣ����K����
T/�� | T2 | T3 |
K | 20.5 | 4.68 |
�ɴ���֪������������ͬ����T1��T2��T3���ֲ�ͬ�¶��£���Ӧ�ӿ�ʼ���ﵽƽ��ʱ����Ҫ��ʱ������� _____________��������T1������T2������T3����
��2������ϵ��ѹ�������½��з�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)��ԭ������SO2��O2�����ʵ���֮����k����ͬʱ��SO2��ƽ��ת�������¶���t���Ĺ�ϵ��ͼ2��ʾ��ͼ��k1��k2��k3�Ĵ�С˳��Ϊ____________��
2SO3(g)��ԭ������SO2��O2�����ʵ���֮����k����ͬʱ��SO2��ƽ��ת�������¶���t���Ĺ�ϵ��ͼ2��ʾ��ͼ��k1��k2��k3�Ĵ�С˳��Ϊ____________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com