
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2 (g) +I2 (g)![]() 2HI(g) 。反应体系中各物质浓度的有关数据如下。
2HI(g) 。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. 平衡时,H2的转化率:丁>甲
B. 平衡时,乙中H2的转化率等于20%
C. HI的平衡浓度:a=b>0.004
D. 丙中条件下,该反应的平衡常数K = 4
【答案】C
【解析】A、恒温恒容,丁与甲相比,各物质浓度增大一倍,为等效平衡,转化率相同,选项A错误;B、甲容器中氢气的转化率为: ![]() ×100%=20%,乙中增大碘的浓度,氢气的转化率增大,大于20%,选项B错误;C、对比甲容器,乙容器中增大碘的浓度,平衡正向移动,碘化氢的浓度增大,丙容器中氢气的浓度增大,平衡正向移动,碘化氢的浓度增大,且两者转化率相同,故:HI的平衡浓度:a=b>0.004,选项C正确;D、平衡常数只与温度有关,温度不变,平衡常数不变,故可以根据甲容器计算丙中条件下的平衡常数。
×100%=20%,乙中增大碘的浓度,氢气的转化率增大,大于20%,选项B错误;C、对比甲容器,乙容器中增大碘的浓度,平衡正向移动,碘化氢的浓度增大,丙容器中氢气的浓度增大,平衡正向移动,碘化氢的浓度增大,且两者转化率相同,故:HI的平衡浓度:a=b>0.004,选项C正确;D、平衡常数只与温度有关,温度不变,平衡常数不变,故可以根据甲容器计算丙中条件下的平衡常数。
H2 (g) +I2 (g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L) 0.01 0.01 0
改变浓度(mol/L) 0.002 0.002 0.004
平衡浓度(mol/L) 0.008 0.008 0.004
K=![]() =0.25,选项D错误。答案选C。
=0.25,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40gmL﹣1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1 120mL(标准状况),向反应后的溶液中加入1.0molL﹣1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是
A. 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
B. 该浓硝酸中HNO3的物质的量浓度是14.0 molL﹣1
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 该合金中铜与镁的物质的量之比是1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量关系为1:2的是( )
A.O3+2KI+H2O═2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项所述的数字不是6的是( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl﹣的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应达到化学平衡状态的重要特征是 ( )
A. 反应停止了 B. 正、逆反应的速率都为0
C. 正、逆反应都还在进行 D. 正、逆反应的速率相等且不为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 6molL﹣1 H2SO4跟锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可采用下列措施( )
A.加碳酸钠(固体)
B.加水
C.加金属钠
D.加浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数(NA)的说法中正确的是( )
A. 常温常压下的33. 6L氯气与27g铝充分反应,转移电子数为3NA
B. 4.6克Na由原子变为Na+时,共失去的电子数为0.2NA
C. 0.1mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA
D. 由CO和O2组成的混合物中共有NA个分子,其中的氧原子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取氯化钠进行焰色反应实验,火焰呈现黄色,显色的原因是( )
A. 氯化钠受热挥发 B. 氯化钠受热分解
C. 钠离子中电子跃迁 D. 氯离子中电子跃迁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体.①A与组合,用于 , ②B与组合,用于 ,
③B与组合,用于 , ④D与组合,用于 . 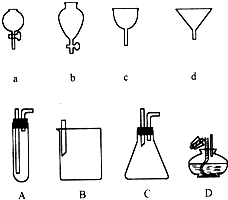
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com