
【题目】聚酯纤维(PET) 结构简式为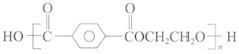 ,其性能优良、应用广泛,产量占合成纤维总量的70%以上,合成原料主要来源于石油和煤的产品。
,其性能优良、应用广泛,产量占合成纤维总量的70%以上,合成原料主要来源于石油和煤的产品。
(1)请你用乙烯和对二甲苯为有机原料,设计该聚酯纤维合成线路: ___________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)。
(2)写出上述流程中发生缩聚反应的化学方程式: ___________。
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
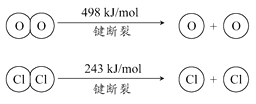
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反应的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=_,该温度下K=_(用分数表示),O2的平衡转化率=__。
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是_。
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
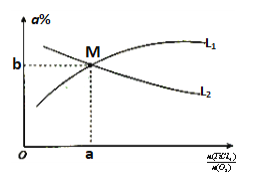
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为___(填“L1”或“L2”),M点的坐标为___(用整数或分数表示)。
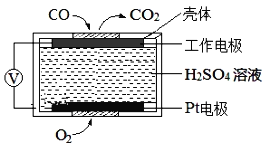
(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为___;为减少对环境造成的影响,用CO和H2可以制备甲醇(CH3OH),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中溶质的主要成分是___(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度____________________。(已知NiO的摩尔质量为74.7gmol-1)
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷。例如:在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2又名黑锰矿,主要用于生产优质软磁铁氧体。MnO2的合成方法按制备工艺中所用原料的不同,分为固相合成和液相合成。已知:MnO2不溶于水,其中锰的价态有+2价,也可能有+3价和+4价。请回答下列问题:
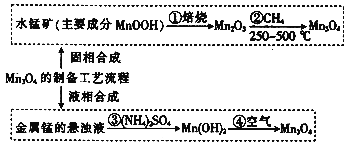
(1)若Mn3O4中锰的价态看作由+2和+4价组成,写出它由氧化物形成的表达式:_____
(2)MnOOH中锰的价态为________价,写出②的化学方程式:____;碱性锌锰干电池的电池反应为:Zn+2MnO2 + 2H2O=Zn(OH)2 + 2MnOOH,写出该电池正极的电极反应式______
(3)将(NH4)2SO4溶于水使锰的悬浊液显酸性,随即缓慢地产生气泡,试用相应的离子方程式解释原因____________。过滤出的Mn(OH)2需要洗涤,简要说明洗涤沉淀的操作过程:________。
(4)若③中收集到672mL(标准状况下)的H2,则理论上可以得到_________g Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y和Z组成的一种化合物可有效灭杀新型冠状病毒,它的结构式为: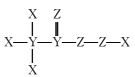 。向W的一种钠盐水溶液中通入YZ2气体,产生沉淀的质量m与通入YZ2气体的体积V的关系如图所示。下列说法正确的是
。向W的一种钠盐水溶液中通入YZ2气体,产生沉淀的质量m与通入YZ2气体的体积V的关系如图所示。下列说法正确的是
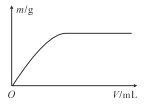
A.氢化物的熔点一定是:Y<Z
B.最高价氧化物对应水化物的酸性:Y>W
C.X、Y、Z三种元素只能组成一种化合物
D.工业上常用热还原法冶炼单质W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)铜和锌相邻,铜和锌的几种状态:①铜:[Ar]3d10;②铜:[Ar]3d104s1③铜:[Ar]3d104p1④锌:[Ar]3d104s1⑤锌:[Ar]3d104s2。它们都失去1个电子时需要的能量由大到小排序为 ___(填字母)。
a.①⑤④②③ b.①④⑤②③ c.②①③⑤④ d.⑤①④③②
画出基态铜原子的价电子排布图____。
(2)Cu2+与NH3·H2O等形成配离子。[Cu(NH3)4]2+中2个NH3被2个H2O取代得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是____(填“正四面体”或“正四边形”)。
(3)CuF2晶体的熔点为836℃。其能量循环图示如下(a、b、c 等均大于0):

F-F键能为 ___kJmol-1,CuF2(s)的晶格能为 ___kJmol-1。
(4)铜常作醇氧化反应的催化剂。M中C原子的杂化类型有 ___种,M的熔沸点比N的高,原因是 ___。
![]()
![]()
![]()
(5)磷青铜晶胞结构如图所示。NA代表阿伏加德罗常数的值,铜、磷原子最近距离为![]()
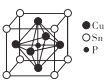
①铜与铜原子最近距离为____nm。
②磷青铜晶体密度为___ gcm-3(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用草酸“沉钴”,再过滤草酸钴得到的母液A经分析主要含有下列成分:
H2C2O4 | Co2+ | Cl- | |
质量浓度 | 20.0g/L | 1.18g/L | 2.13g/L |
为了有效除去母液A中残留的大量草酸,一般用氯气氧化处理草酸,装置如下:
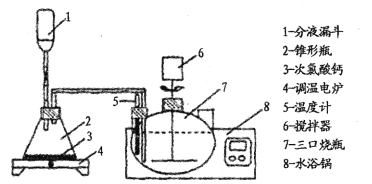
回答下列问题:
(1)母液A中c(CoO2)为____mol·L-1。 ,
(2)分液漏斗中装入盐酸,写出制取氯气的离子方程式 ____________。反应后期使用调温电炉加热,当锥形瓶中____(填现象)时停止加热。
(3)三颈烧瓶反应温度为50℃,水浴锅的温度应控制为 ____(填序号)。
A.50℃ B.5l-52℃ C.45 - 55℃ D.60℃
(4)氯气氧化草酸的化学方程式为________ 。
(5)搅拌器能加快草酸的去除速率,若搅拌速率过快则草酸去除率反而降低,主要原因是__________。
(6)若用草酸铵代替草酸“沉钴”,其优点是____ ,其主要缺点为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
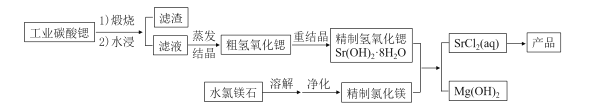
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com