
【题目】甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注
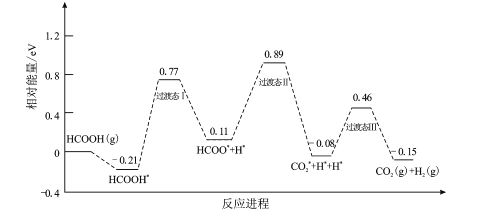
回答下列问题:
(1)该历程中决速步骤的能垒(活化能)E正=__________eV,该步骤的反应方程式为__________
(2)甲酸分解制氢气的热化学方程式为__________
(3)在温度为383K压强为p0时,将一定量的HCOOH气体充入一个盛有催化剂的刚性容器中,达到平衡时,H2的分压为0.55p0,则该反应α(HCOOH)=______________,该温度下的压强平衡常数Kp=__________ (计算结果保留2位有效数字)
(4)HCOOH的分解存在副反应HCOOH(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
已知H2的选择性=![]() 能够增大H2选择性的可能方法是____
能够增大H2选择性的可能方法是____
(5)甲酸作为直接燃料电池的燃料具有能量密度高的优点若电解质溶液显酸性,甲酸直接燃料电池的负极反应式为__________,该电池的理论输出电压为1.48V,能量密度E=________kW·h/kg(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J)
【答案】0.98 HCOOH*=HCOO*+H* HCOOH(g)=CO2(g)+H2(g) △H=-0.15NAeV/mol 55% 0.67p0 选择合适催化剂 HCOOH-2e-=CO2↑+2H+ 1.72
【解析】
(1)反应所需能垒(活化能)越大,反应速率越慢,而决定该历程反应速率的是反应速率最慢的一步,即决速步骤是能垒最高的一步,该历程中三步的能垒分别为[0.77-(-0.21)]eV=0.98eV、(0.89-0.11)eV=0.78eV、[0.46-(-0.08)]eV=0.54ev,所以该历程中决速步骤的能垒(活化能)E正=0.98eV,该步骤的反应方程式为HCOOH*=HCOO*+H*,故答案为:0.98;HCOOH*=HCOO*+H*;
(2)结合反应历程可知,1molHCOOH(g)分解得到1molCO2(g)和1molH2(g)释放0.15eV能量,所以甲酸分解制氢气的热化学方程式为HCOOH(g)=CO2(g)+H2(g)△H=-0.15NAeV/mol,故答案为:HCOOH(g)=CO2(g)+H2(g)△H=-0.15NAeV/mol;
(3)因为是刚性容器,所以可将分压代入三段式解答,平衡时,H2的分压为0.55p0,所以: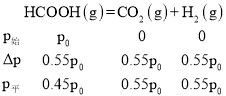 ,所以,α(HCOOH)=
,所以,α(HCOOH)=![]() =55%,Kp=
=55%,Kp=![]() ≈0.67p0,故答案为:55%;0.67p0;
≈0.67p0,故答案为:55%;0.67p0;
(4)可选择合适的催化剂增大氢气的选择性,故答案为:选择合适的催化剂;
(5)甲酸作燃料,失电子,发生的电极反应为:HCOOH-2e-=CO2↑+2H+,1molHCOOH反应转移2mol电子,则1000gHCOOH转移![]() ×2mol电子,所以电池输出电能=1.48V×
×2mol电子,所以电池输出电能=1.48V×![]() ×2mol×96500C/mol,则能量密度E=
×2mol×96500C/mol,则能量密度E=
![]() J/kg=
J/kg= kW·h/kg≈1.72kW·h/kg,故答案为:HCOOH-2e-=CO2↑+2H+;1.72。
kW·h/kg≈1.72kW·h/kg,故答案为:HCOOH-2e-=CO2↑+2H+;1.72。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是__(填序号)。
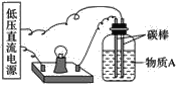
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是__(填字母)。
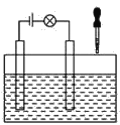
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(3)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。若在(2)题图中,电解质溶液为Ca(OH)2溶液,向溶液中逐渐通入CO2。则:下列四个图中,__(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
A.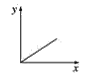 B.
B.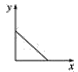 C.
C.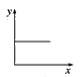 D.
D.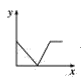
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科技工作者设计了一种电解装置,能合成氨及硝酸,实现高效人工固氮,原理如图所示下列说法正确的是
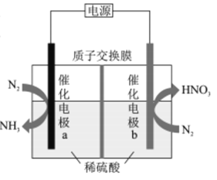
A.催化电极a的电势比催化电极b的电势高
B.负极区的电极反应为N2-10e-+6H2O=2NO3-+12H+
C.若N2得到6mole-,有6molH+向电极b迁移
D.理论上1molN2参与反应转移的电子数为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理食品加工公共场所等清洁消毒,结构如图甲所示其中WXYRZ均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期
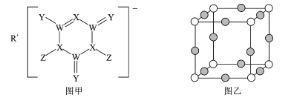
回答下列问题:
(1)SDIC中,电负性最小的元素是____(填元素名称) ,其中W最外层的孤电子对数为__________。
(2)基态X3-的核外电子排布式为____某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满KLM3个能层,则M的元素符号是___ ,该晶体晶胞结构如图乙所示,则X3-的配位数为____
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中____(填“σ”或“π”)键更稳定
(4)X的最简单氢化物是___ 分子(填“极性”或“非极性”),该分子与1个H+结合形成离子时键角___ (填“变大”“变小”或“不变”),原因是____
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是____
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中已知晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体密度为____g/cm3 (列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)H2可以在![]() 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____![]() 填“甲”或“乙”
填“甲”或“乙”![]() 。
。
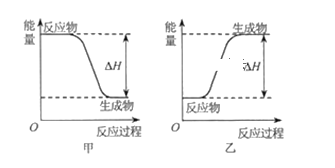
查看答案和解析>>
科目:高中化学 来源: 题型:
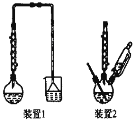
【题目】某废催化剂含SiO2、ZnO、ZnS和CuS。实验室从该废催化剂中回收锌和铜的一种流程如下图所示。
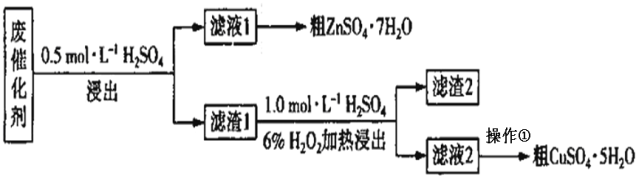
浸出使用的装置如图所示。回答下列问题:
 蒸发浓缩、冷却结晶蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶蒸发浓缩、冷却结晶
(1)第一次浸出必须选用装置 _______(填“1”或“2”),原因是 ________。滤渣1的主要成分有_______。
(2)第二次浸出时生成单质硫,写出反应的离子方程式:_______________。该步骤即使加热温度不高也可能会有副反应发生,产物之一是空气的主要成分,分析可能原因是_____________________ 。
(3)从滤液2中得到CuSO4·5H2O的操作是 __________ 、过滤、洗涤。
(4)下列叙述中涉及到与该流程中的“操作①”相同操作的是_____________ 。
A.《肘后备急方》中治疟疾:“青蒿一握,以水升渍,绞取汁,尽服之”
B.《本草衍义》中精制砒霜:“将生砒就置火上,以器覆之,令砒烟上飞着覆器”
C.《开宝本草》中获取硝酸钾:“冬月地上有霜,扫取以水淋汁后,乃煎炼而成”
D. 《本草纲目》中烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”
(5)若该废催化剂中含12.8%的CuS,实验中称取15.0g废催化剂最终得到3.0gCuSO4·5H2O,则铜的回收率为 __________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com