
 如图铅蓄电池是一种典型的可充电电池,电池总反应式为
如图铅蓄电池是一种典型的可充电电池,电池总反应式为| 放电 |
| 充电 |
| A、放电时,电流方向由B过M到A |
| B、充电时,铅蓄电池的正极应与充电器电源的负极相连 |
| C、放电时,正极反应是Pb-2e-+SO42-═PbSO4 |
| D、充电时,阳极反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、CH3COONH4与H2N-CH2-COOH是同分异构体 |
| B、CH3CH2Cl与CH2ClCH3是同分异构体 |
| C、H2N-CH2-COOH与CH3-CH2-NO2是同分异构体 |
D、 与CH3CHO是同分异构体 与CH3CHO是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH5与水的反应是氧化还原反应 |
| B、NH5由分子构成 |
| C、NH5属于离子化合物 |
| D、NH5中N的化合价为-5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是NaCl晶体的一个晶胞结构模型.KO2的晶体结构与NaCl相似,KO2可以看作是
如图是NaCl晶体的一个晶胞结构模型.KO2的晶体结构与NaCl相似,KO2可以看作是| A、与K+距离相等且最近的K+有12个 |
| B、与K+距离相等且最近的O2-构成的多面体是正八面体 |
| C、与K+距离相等且最近的O2-共有8个 |
| D、一个KO2晶胞中摊得的K+和O2-粒子数均为4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠比较柔软 |
| B、钠与水反应生成碱 |
| C、钠与水反应放热 |
| D、钠与水反应放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
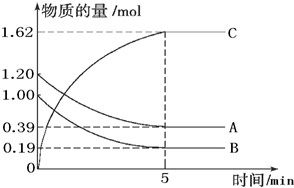
| A、v(A)=0.5mol?L-1?min-1 |
| B、v(B)=1.2mol?L-1?min-1 |
| C、v(C)=0.4mol?L-1?min-1 |
| D、v(C)=1.1mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com