
| A.1L0.5mol/L的NaOH溶液 | B.1L0.4mol/L的NaNO3溶液 |
| C.1L0.3mol/L的NaCl溶液 | D.1L0.2mol/L的Na3PO4溶液 |
科目:高中化学 来源:不详 题型:单选题
| A.配制标准溶液的固体NaOH中混有杂质KOH |
| B.滴定终点读数时,俯视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
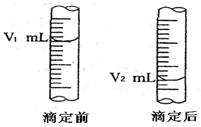
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01 mol?L-1 | B.0.017 mol?L-1 | C.0.05 mol?L-1 | D.0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测得该液体pH=7 |
| B.测其KW为1×l0-14 |
| C.向其中投入金属钠,钠于液面上迅速游动,并发出丝丝声 |
| D.在1.0l×l05Pa压强下测得沸点为100℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com