
【题目】有机物F(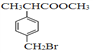 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
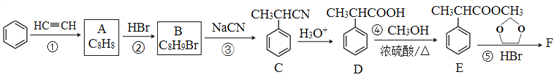
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。
的合成路线_________________。
【答案】 ![]() 16 酯基 ①②
16 酯基 ①② 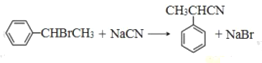 乙二醇 23
乙二醇 23 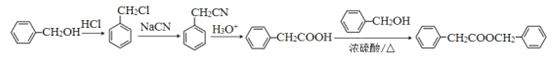
【解析】试题分析:根据C的结构简式,逆推B是![]()
;A是苯乙烯; 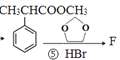 ,F是
,F是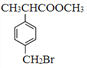 ,根据原子守恒,可知另一种产物是乙二醇;综合分析①②③④⑤分别是加成反应、加成反应、取代反应、取代反应、取代反应。
,根据原子守恒,可知另一种产物是乙二醇;综合分析①②③④⑤分别是加成反应、加成反应、取代反应、取代反应、取代反应。
解析:根据以上分析,(1)A是苯乙烯,结构简式为![]() ,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16 个原子共平面。
,分子中苯环、乙烯分别为2个平面,单键可旋转,所以所有原子可能处于同一平面,最多有16 个原子共平面。
(2)E中官能团名称是酯基,①~④分别是加成反应、加成反应、取代反应、取代反应,属于加成反应的是①②。
(3)反应③的化学方程式为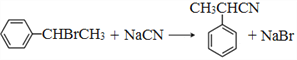 。
。
(4) ,F是
,F是 ,根据原子守恒,可知另一种产物是乙二醇。
,根据原子守恒,可知另一种产物是乙二醇。
(5)①能与FeCl3溶液发生显色反应,说明含有酚羟基; ②能发生银镜反应,说明由醛基; ③分子中有1个甲基,满足以上条件的D的同分异构体有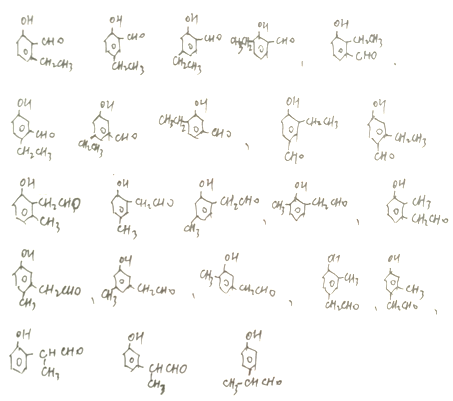
,共23种。
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线。
的合成路线。![]() 与HCl取代反应生成
与HCl取代反应生成![]() ,
,![]() 与NaCN取代反应生成
与NaCN取代反应生成![]() ,
,![]() 水解为
水解为![]() ,最后
,最后![]()
与苯甲醇发生酯化反应生成![]() ,所以合成路线为
,所以合成路线为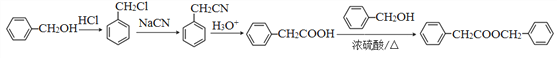


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性![]() 溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。

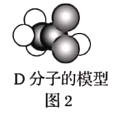
请回答下列问题:
(1)A的结构简式为_____,E中的官能团名称为______。
(2)由B生成C的反应类型是_____,由B生成E的反应类型是___。
(3)A反应生成B的化学方程式为____。
(4)B在一定条件下可以生成某种高分子化合物,该高分子化合物的链节是_____。
(5)C物质存在一种同分异构体,该同分异构体属于有毒的一类致癌物,其别名为恶烷,曾被广泛的用于洗涤,制药,印染等行业,试推测其结构简式_____。
(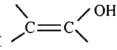 结构不稳定)
结构不稳定)
(6)C在![]() 条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
(7)在实验室中取![]() 和
和![]() 在浓硫酸催化条件下得到
在浓硫酸催化条件下得到![]() ,试计算该反应产物的产率是______。(保留三位有效数字)
,试计算该反应产物的产率是______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
①上述反应符合“原子经济"原则的是__________(填“I”或“II”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为__________热反应(填“吸"或“放”)。
③某温度下,将1mol CO和3mol H2充入1L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为___________(从表中选择)。
(2)现以甲醇燃料电池。采用电解法来处理酸性含铬废水(主要含有Cr2O72—)时,实验室利用下图装置模拟该法:
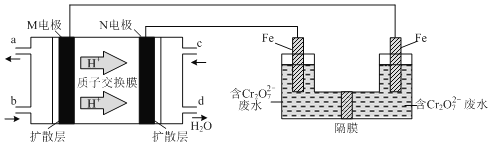
①N电极的电极反应式为_____________________。
②请完成电解池中Cr2O72—转化为Cr3+的离子反应方程式:(______) Cr2O72-+(_____) Fe2++(______)═(_____) Cr3+ +(______)Fe3++(_____) H2O
(3)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10—5mol-L-1时,Cr3+沉淀完全,此时溶液的pH=_____________(已知,Ksp[Cr(OH)3]=1.0×10-32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫废水的主要超标项目为悬浮物、重金属阳离子(Hg2+、Cu2+等)、SO42-。某工厂采用如下流程进行脱硫废水处理。其中助凝剂为聚丙烯酰胺![]()
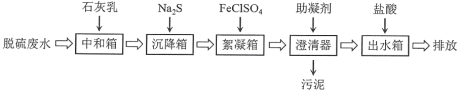
下列说法不正确的是
A.该方案用石灰乳仅用来调节pH使大部分重金属阳离子形成氢氧化物沉淀
B.加入Na2S可以将进入沉降箱的Hg2+,Cu2+转化为硫化物沉淀
C.加入FeClSO4是利用Fe3+易水解的性质,形成胶体吸附悬浮物
D.助凝剂聚丙烯酰胺是加成聚合反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算:
(1)同温同压下,等质量的SO2气体和CO气体密度之比为________;体积比为________;原子个数比为________。
(2)某混合溶液中只含有下列几种离子:Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为0.2mol/L、0.25mol/L、0.5mol/L、0.25mol/L,则c(Al3+)=________。
(3)在标准状况下,某混合气体密度是2.86gL-1,该混合气体的平均相对分子质量是________;现有质量比为11:7的CO2和CO的混合气体,该混合气体的摩尔质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com