
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
①上述反应符合“原子经济"原则的是__________(填“I”或“II”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为__________热反应(填“吸"或“放”)。
③某温度下,将1mol CO和3mol H2充入1L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为___________(从表中选择)。
(2)现以甲醇燃料电池。采用电解法来处理酸性含铬废水(主要含有Cr2O72—)时,实验室利用下图装置模拟该法:
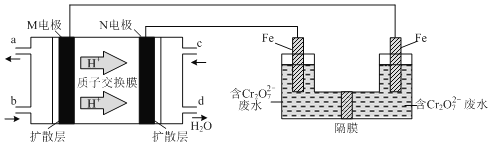
①N电极的电极反应式为_____________________。
②请完成电解池中Cr2O72—转化为Cr3+的离子反应方程式:(______) Cr2O72-+(_____) Fe2++(______)═(_____) Cr3+ +(______)Fe3++(_____) H2O
(3)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10—5mol-L-1时,Cr3+沉淀完全,此时溶液的pH=_____________(已知,Ksp[Cr(OH)3]=1.0×10-32)
【答案】I 放热 80% 250℃ O2+4e+4H+=2H2O 1 6 14H+ 2 6 7 5
【解析】
(1)①根据“原子经济”定义解答;
②由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
③某温度下,将1molCO和3molH2充入1L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L): 1 3 0
变化浓度(mol/L): 0.8 1.6 0.8
平衡浓度(mol/L): 0.2 1.4 0.8
由此计算CO转化率和此温度下平衡常数,进而判断温度;
(2)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式;
(3)Ksp=c(Cr3+)×c3(OH-)=1×1032计算c(OH-),根据KW=c(H+)×c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算。
(1)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中,由此可知,更符合原子经济的是I;
②由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
③某温度下,将1molCO和3molH2充入1L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L): 1 3 0
变化浓度(mol/L): 0.8 1.6 0.8
平衡浓度(mol/L): 0.2 1.4 0.8
CO转化率=![]() ×100%=80%,平衡常数K=
×100%=80%,平衡常数K=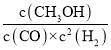 =
=![]() =2.041,故温度为250℃,
=2.041,故温度为250℃,
故答案为:放热;80%;250℃;
(2)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH6e+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e+4H+=2H2O,
故答案为:O2+4e+4H+=2H2O;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1;6;14H+;2;6;7;
(3)Ksp=c(Cr3+)×c3(OH)=1×10-32,c(Cr3+)=1×10-5mol·L1时,溶液中c(OH)= =
=![]() =1×10-9mol·L1,则c(H+)=
=1×10-9mol·L1,则c(H+)=![]() =
=![]() mol/L=1×10-5mol·L1,则pH=lg(1×10-5) =5。
mol/L=1×10-5mol·L1,则pH=lg(1×10-5) =5。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
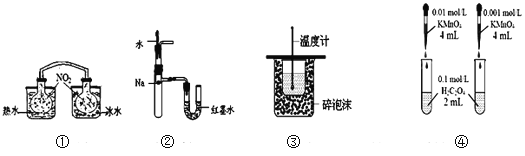
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固体 ③滴入几滴浓盐酸
固体 ③滴入几滴浓盐酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加几滴硫酸铜溶液
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用![]() 的盐酸
的盐酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(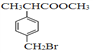 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
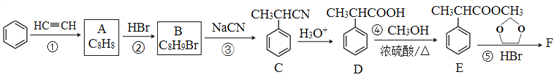
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
①NH3![]() NO
NO![]() HNO3
HNO3
②浓HCl![]() Cl2
Cl2![]() 漂白粉
漂白粉
③MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A.①②⑤B.①④⑤C.②③④D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁的氧化物样品,用140 mL 5 mol·L-1的盐酸恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com