
【题目】下列液体中,不会出现丁达尔现象的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液 ⑤Fe(OH)3胶体 ⑥肥皂水.
A.②④B.③④C.②④⑥D.④
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
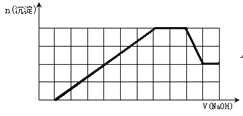
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C. 原溶液中一定含有SO42-和Na+
D. 反应最后形成的溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴化钾、碘化钾的混合溶液中通入足量的氯气,再加热将溶液蒸干并灼烧,最后残留的物质是( )
A.KClB.KCl、I2C.KCl、KBrD.KCl、Br2、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
滴定次数 | 用去NaOH溶液的体积 | ||
滴定前刻度 | 滴定后刻度 | 体积(mL) | |
1 | 3.20 | 22.48 | |
2 | 1.23 | 20.55 | |
3 | — | — | |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是()
A.酸式滴定管
B.烧杯
C.100 mL容量瓶
D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用。
(4)滴定操作时,左手应 , 观察滴定管里液面的高度时应注意。
(5)选用的合适指示剂是 , 变色情况是。
(6)计算稀释后容量瓶中醋酸的物质的量浓度。
(7)计算“老谢琼醋”中醋酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2 , 含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。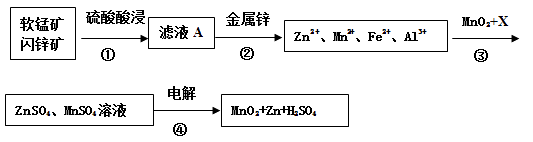
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是。
(3)步骤③中MnO2的作用是 ,另外一种物质X可以是 。
A.ZnO B.MgCO3 C. MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2 , 它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式。
(5)已知:HCN的电离常数K=4.9×10-10 , H2S的电离常数K1=1.3×10―7 , K2=7.0×10―15 , 向NaCN溶液中通入少量的H2S气体,反应的离子方程式为。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、冰水混合物
C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是( )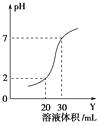
A | B | C | D | |
X浓度/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
Y浓度/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣═2Fe2++I2+3H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO ![]() ?+6H++5H2O2═2Mn2++5O2↑+8H2O
?+6H++5H2O2═2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配置一定物质的量浓度的Na2CO3溶液,下列操作正确的是
A.称量时,将Na2CO3固体直接放在托盘天平的右盘上
B.将Na2CO3固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com