
某温度下,向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是
| A.M点所示溶液中c( NH4+)>c(Cl-) |
| B.Q点所示溶液的导电熊力强于M点 |
| C.Q点消耗盐酸的体积等于氨水的体积 |
| D.M点和N点所示溶液中水的电离程度相同 |
C
解析试题分析:A、M点的pH值大于pOH值,所以溶液中氢离子浓度小于OH-浓度,即溶液显碱性。所以根据电荷守恒c( NH4+)+c(H+)=c(Cl-)+c(OH-)可知,M点所示溶液中c( NH4+)>c(Cl-),A正确;B、Q点所示溶液中pH值等于pOH值,说明溶液显中性。由于向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸时,溶液的酸碱性变化为碱性→中性→酸性,而氨水是弱碱,因此Q点的导电熊力强于M点,B正确;C、氨水与盐恰好反应时,生成的NH4+水解溶液显酸性。而Q点显中性,说明氨水过量,所以Q点消耗盐酸的体积小于氨水的体积,C不正确;D、M点氨水过量,N点盐酸过量,且N点溶液中氢离子浓度与M点溶液中OH-浓度相等,所以M点和N点所示溶液中水的电离程度相同,D正确,答案选C。
考点:考查酸碱中和反应、溶液中离子浓度比较、溶液导电性、酸碱性以及外界条件对水电离平衡的影响


科目:高中化学 来源: 题型:单选题
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= mol·L-1,c(CH3COOH)= mol·L-1;
(3)CH3COOH的电离平衡常数Ka= (用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于电解质溶液的叙述正确的是 ( )。
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
今有室温下四种溶液,有关叙述不正确的是( )
| | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
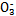 )>c(S
)>c(S )>c(OH-)
)>c(OH-)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com