
【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=37.4kJ·mol-1
S(l)+2CO2(g) △H1=37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)=______;在20min时,温度T2下,该反应的化学平衡常数为_______。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的_____(填序号)。
CH3OH(g)反应达到平衡状态的_____(填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2
2NO2的正反应速率v正=k1Cm(NO)Cn(O2

则k1=____,m=_____,n=_____。
【答案】CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41.4 kJ·mol-1 0.05mol/(L·min) 225 减小 增大压强或增大氢气浓度或按原比例等倍加入反应物 bd 1596 2 1
H2(g)+CO2(g) △H=-41.4 kJ·mol-1 0.05mol/(L·min) 225 减小 增大压强或增大氢气浓度或按原比例等倍加入反应物 bd 1596 2 1
【解析】
(1)利用盖斯定律通过a+b得到CO和水蒸气完全反应生成H2和CO2的热化学方程式;
(2)①利用三段式解答:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
C始(mol/L): 1 2 0
ΔC(mol/L): 0.5 1 0.5
C10min(mol/L): 0.5 1 0.5
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
C10min(mol/L): 0.5 1 0.5
ΔC(mol/L): 0.4 0.8 0.4
C20min(mol/L): 0.1 0.2 0.9
再根据速率计算公式![]() ,
,![]() 进行计算;
进行计算;
②对于放热反应,温度升高,平衡逆行移动,平衡常数减小;
③温度已经定下来,不考虑温度,则可以考虑改变压强和反应物浓度;
④a.不同的物质反应速率判断平衡:速率之比等于化学方程式中的化学计量数之比,但必须是不同方向的速率;
b.对气体物质,若反应前后的物质都是气体,且化学计量数不等,总物质的量保持不变可判断平衡;
c.正反应消耗掉反应物的速度等于逆反应生成该反应物的速度,可以判断平衡;
d.对气体物质,若反应前后的物质都是气体,且化学计量数不等,平均相对分子质量不变保持不变可判断平衡;
(3)k1、m、n三个未知数,表格中有三组数据,能列出方程组,解出k1、m、n。
(1)将(a+b)/2得:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41.4 kJ·mol-1;答案为:CO(g)+H2O(g)
H2(g)+CO2(g) △H=-41.4 kJ·mol-1;答案为:CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41.4 kJ·mol-1;
H2(g)+CO2(g) △H=-41.4 kJ·mol-1;
(2)①容器体积为2L,根据表格数据列出三段式:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
C始(mol/L): 1 2 0
ΔC(mol/L): 0.5 1 0.5
C10min(mol/L): 0.5 1 0.5
则:![]() ;
;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
C10min(mol/L): 0.5 1 0.5
ΔC(mol/L): 0.4 0.8 0.4
C20min(mol/L): 0.1 0.2 0.9
![]() ;答案为:0.05mol/(L·min);225;
;答案为:0.05mol/(L·min);225;
②对于CO(g)+2H2(g)![]() CH3OH(g),△H<0是放热反应,温度升高,平衡逆行移动,平衡常数减小;答案为:减小;
CH3OH(g),△H<0是放热反应,温度升高,平衡逆行移动,平衡常数减小;答案为:减小;
③增大压强,反应速率增大,平衡正向移动,CO平衡转化率提高;增大氢气的浓度,反应速率增大,平衡正向移动,CO平衡转化率提高;答案为:增大压强或增大氢气浓度或按原比例等倍加入反应物;
④a.2v正(H2)=v逆(CH3OH),v正(H2):v逆(CH3OH)=1:2,不等于化学计量数之比,不能作为判断平衡的标志;
b.CO(g)+2H2(g)/span>![]() CH3OH(g),左右气体化学计量数不等,混合气体的物质的量不再变化可判断平衡;
CH3OH(g),左右气体化学计量数不等,混合气体的物质的量不再变化可判断平衡;
c.单位时间内有1 mol CO消耗同时消耗2molH2都是正反应,不可以判断平衡;
d.CO(g)+2H2(g)![]() CH3OH(g),左右气体化学计量数不等,平均相对分子质量不变保持不变可判断平衡;
CH3OH(g),左右气体化学计量数不等,平均相对分子质量不变保持不变可判断平衡;
答案:bd;
(3)将三组数据分别代入v正=k1Cm(NO)Cn(O2)得:
![]()
![]()
![]()
解得:k1=1596,m=2,n=1;
答案:1596;2;1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)该反应平衡常数的表达式为K=_______________A点处,v(正) ______ v(逆),A点正反应速率 ______ B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是 ______ .用NO2表示从0~2s内该反应的平均速率v= ______ .

(3) 能说明该反应已经达到平衡状态的是 ______ .
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)
c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是 ______ .
a.适当升高温度b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X元素是地壳中含量最多的元素,Y元素是空气中含量最多的元素,A元素与Y同主族,且是该主族中原子序数最大的非金属元素,D元素位于周期表中第三周期,其最高氧化态可与A形成D3A2。下列说法错误的是
A. 对应酸的酸性:A2X5<A2X3B. 简单离子半径:A>Y>X>D
C. A元素的原子结构示意图: D. 非金属性:X>Y
D. 非金属性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
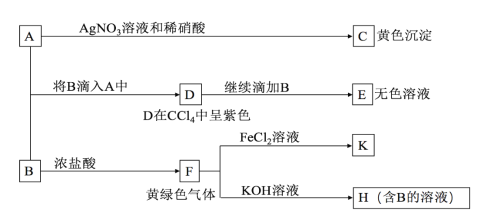
请回答:
(1)C的化学式为_________,检验气体F常用的试纸是______________
(2)写出物质M在生活中的常见用途______________
(3)写出F→H的化学方程式:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列氧化还原反应,指出氧化剂、还原剂、氧化产物
①2Na+2H2O=2NaOH+H2↑
氧化剂_____还原剂_____氧化产物_____
②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
氧化剂_____还原剂______氧化产物_____
(2)用双线桥表示下列反应的电子转移
2H2S+SO2=3S↓+2H2O_____
H2S +H2SO4=SO2↑+S↓+2H2O_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com