
| A、Na2CO3?H2O |
| B、Na2CO3?5H2O |
| C、Na2CO3?6H2O |
| D、Na2CO3?10H2O |
| 3.72 |
| 106+18x |
| 3.18 |
| 106 |


科目:高中化学 来源: 题型:

| A、①装置用于检验1-溴丙烷消去产物 |
| B、②装置用于石油的分馏 |
| C、③装置用于实验室制硝基苯 |
| D、④装置可装置证明酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯丙烷与NaOH溶液共热后,再加入AgNO3溶液,检验溶液中的氯离子 |
| B、苯酚沾在手上,立即用NaOH溶液清洗,然后再用大量的水冲洗 |
| C、纯净的苯酚是粉红色晶体,65℃以上时能与水互溶 |
| D、配制银氨溶液时,将氨水慢慢滴到AgNO3溶液中,直到最初产生的沉淀恰好溶解为止 |
| E、可用稀硝酸清洗做完银镜反应后的试管 |
| F、向苯酚溶液中加入少量的FeCl3溶液有紫色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
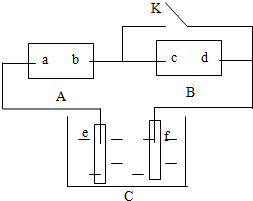 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种纯净物,但没有固定的熔点 |
| B、是一种晶体 |
| C、不属于晶体,是一种玻璃态物质 |
| D、是一种硬而脆的物质,有固定的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、一定条件,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3 kJ,则其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、常温下反应C(s)+CO2(g)═2CO(g)不能自发进行是由于该反应△H>0 |
| D、已知25℃时,HCl(aq)和NaOH(aq)反应的中和热△H=-57.3 kJ?mol-1,则H2SO4(aq)和Ba(OH)2(aq)反应的中和热为△H=-114.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com