
| A、乙醇和乙酸在一定条件下能发生酯化反应 |
| B、乙酸能溶于水,但不溶于乙醇 |
| C、乙醇和乙酸均能使紫色石蕊试液变红 |
| D、乙醇和乙酸分子中都含有C=O键 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、H2O、AgNO3、HNO3 |
| B、H2O、NaOH、HNO3 |
| C、H2O、NaOH、HCl |
| D、H2O、KOH、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶的体积标线刻在瓶颈上 |
| B、量筒的“0“标线在中间 |
| C、量筒最下端刻有“0“标线 |
| D、托盘天平刻度尺有“0“标线,刻在尺的中间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 |
| B、向油脂发生皂化反应后所得的混合溶液中加入固体NaCl会出现分层现象,此过程发生的主要是物理变化 |
| C、纤维素的水解实验操作为:把一小团棉花放入试管中,加入几滴90%的硫酸溶液,用玻璃棒把棉花捣成糊状,小火微热,至成亮棕色溶液 |
| D、油脂、乙醇是人体必需的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| NaOH/H2O |
| △ |
| O2(Cu) |
| △ |
| HCN |
| 加成 |
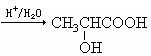
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 |
| B、酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 |
| C、煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来 |
| D、石油中含有C5~C11的烷烃,可以通过分馏得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:
在一固定容积的密闭容器中进行着反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度的关系如下:| t℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com