
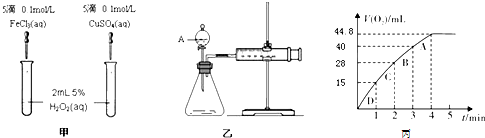
| △c |
| △t |
| △c |
| △t |
| ||
| 28×10-3L |
| 22.4L/mol |
| ||
| 2 |
| 28×10-3 |
| 44.8 |
| 28×10-3 |
| 44.8 |
| 28×10-3 |
| 22.4 |
| 28mL |
| 44.8mL |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在HCl气流中加热使之脱水 |
| B、在NH3气流中加热使之脱水 |
| C、加入P2O5固体加热使之脱水 |
| D、加入H2SO4加热使之脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 现象及结论 |
| 取适量晶体于烧瓶中,加入足量3mol?L-1H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有 | 则晶体中含Na2CO3杂质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中的溶解度:碳酸钠>碳酸氢钠 |
| B、热稳定性:碳酸钠>碳酸氢钠 |
| C、溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH |
| D、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(HCOO-) |
| B、0.01mol/L的HCOOH溶液中加水稀释,溶液中c(OH-)减小 |
| C、HCOOH溶液中加少量的HCOONa固体,平衡逆向移动 |
| D、常温下pH=2的HCOOH溶液与pH=12的NaOH溶液等体积混合后,pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com