
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
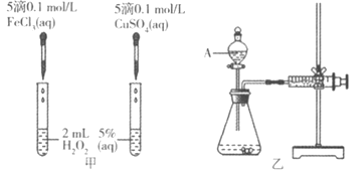
(1)定性如图甲可通过观察________________现象,定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是________________
(2)定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为________________,实验中需要测量的数是________________
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。A、B、C、D各点反应速率由快到慢的顺序为________。
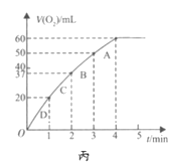
【答案】单位时间内产生气泡的快慢 消除阴离子不同对实验的干扰 分液漏斗 产生40mL气体所需的时间 D>C>B>A
【解析】
(1)过氧化氢分解会放出氧气,比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排除阴离子的干扰;
(2)根据常用的仪器名称分析,该反应是通过反应速率分析的,所以根据v=![]() 分析;
分析;
(3)根据v=![]() ,结合图像比较反应速率快慢。
,结合图像比较反应速率快慢。
(1)定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件完全相同,所以将CuSO4改为CuCl2更为合理,可以避免由于阴离子不同造成的干扰,故答案为:单位时间内产生气泡的快慢;消除阴离子不同对实验的干扰;
(2)A仪器是有活塞能控制滴加速率的漏斗,名称是分液漏斗;实验时均以生成40mL气体为准,根据v=![]() ,还需要测定产生40mL气体所需的时间,故答案为:分液漏斗;产生40mL气体所需的时间;
,还需要测定产生40mL气体所需的时间,故答案为:分液漏斗;产生40mL气体所需的时间;
(3)根据图象结合v=![]() 知,图像中各点的斜率越大,反应速率越快,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A。
知,图像中各点的斜率越大,反应速率越快,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,故答案为:D>C>B>A。


科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____(写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______。
(4)“氧化”时发生反应的化学方程式为_____。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____。(已知:Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____(填下列各项中序号)。




查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+I2(g)===
(g)+I2(g)===![]() (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
②环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(2) 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

下列可判断反应达到平衡状态的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.  不再变化
不再变化
d.c(I-)=y mol·L-1
(3)已知反应2HI(g) ![]() H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g) ![]() 2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) H=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(S)+2NO(g)+Cl2(g) K2
2NaNO3(S)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________________;
(2)已知几种化学键的键能数据如下表(NO分子中氮氧键键能为630 kJ/mol,亚硝酸氯的结构为Cl-N=O):
化学键 | N | Cl-Cl | Cl-N | N=O |
键能/kJmol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的△H3和a的关系为△H3=________;
2ClNO(g)反应的△H3和a的关系为△H3=________;
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl(g),在不同温度下测得c(ClNO)与时间的关系如图A:
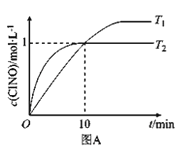
①由图A可判断T1________T2,该反应的△H________0(填“>”“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=________;
③T2时该反应的平衡常数K=____________;
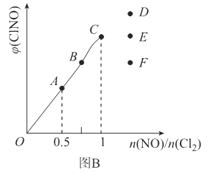
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化如图B,则A、B、C三状态中,NO的转化率最大的是________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)![]() 2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
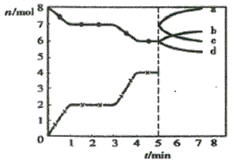
A.0~1min,v(CO)=1 mol/(L·min);1~3min时,v(CO)=v(CO2)
B.当容器内的压强不变时,反应一定达到平衡状态,且![]()
C.3min时温度由T1升高到T2,则Q>0,再达平衡时![]()
D.5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com