
【题目】经催化加氢后可以生成 2甲基戊烷的是
A.CH2=CHCH(CH3)CH2CH3B.CH≡CCH(CH3)CH2CH3
C.CH3C(CH3)=CHCH2CH3D.CH3CH=C(CH3)CH2CH3
科目:高中化学 来源: 题型:
【题目】在2 L固定容积的密闭容器中,800 ℃时发生反应2NO(g)+O2(g)![]() 2NO2(g)。该体系中,n(NO)随时间的变化如下表:
2NO2(g)。该体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.012 | 0.009 | 0.008 | 0.0075 | 0.0075 |

反应过程如上图所示,a、b、c、d其中只有3条曲线是正确的。请回答:
(1)图中表示NO2的变化的曲线是________,A点时,v(正)______v(逆) (填“大于”“小于”或“等于”,下同)。用O2表示从0~3 s内该反应的平均速率v=____________。
(2)能说明该反应已经达到平衡状态的是________ (填字母)。
a.混合气体的平均摩尔质量不变 b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
e.相同时间内,每消耗2a mol的NO同时生成等量的NO2
f.混合气体中O2和NO2物质的量之比为1∶2的状态
(3)已知上述反应为放热反应,达平衡后改变条件继续进行。在t1~t6内反应速率与时间图像如图,在每一时刻均只改变一个影响反应速率的因素,则下列说法正确的是__________。

A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t0~t1时X的转化率最高
(4)能使该反应的反应速率增大的是________(填字母)。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组对某样品W(组成用CxHyOzNaSb表示)进行探究。
实验一:确定W中元素组成
(1)取W样品,将有机氮转化成NH4+,_____________(补充实验方案),证明W中含氮元素。
(2)用燃烧法确定W样品中含碳、氢、硫三种元素,装置如图所示。
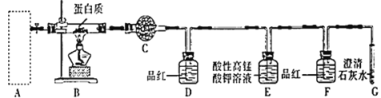
①A框内是加热固体制备氧气发生装置,写出A中反应的化学方程式:__________________。
②写出E中发生反应的离子方程式:_________________。
③从实验简约性考虑,D、E、F、G装置可以用下列装置替代:

能证明W含碳元素的实验现象是__________________。
实验二:测定W中硫元素含量
(3)取wgW样品在过量的氧气中充分燃烧,用V1mLc1mol·L-1碘水溶液吸收SO2,用V2mLc2mol·L-1Na2S2O3溶液滴定过量的I2。已知:2Na2S2O3+I2=2NaI+Na2S4O6。滴定终点的标志是__________________。该W样品中硫元素的质量分数为_________%。
(4)二氧化硫通入吸收液前必须通过过量的赤热铜粉(SO2不参与反应),否则会导致测定的硫元素质量分数_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是( )
A.所有△H<0的反应均是自发反应
B.高锰酸钾加热分解是一个熵减小的过程
C.自发进行的反应一定能迅速进行
D.冰在室温下自动熔化成水,是熵增的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中c(SO32-)/c(Fe3+)变化的曲线如图所示。实验发现:

i. a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ii. c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。下列分析合理的是
A. 向a点溶液中滴加BaCl2溶液,无明显现象
B. b点较a点溶液pH升高的主要原因:2Fe3+ + SO32- + H2O === 2Fe2+ + SO42- + 2H+
C. c点溶液中发生的主要反应:2Fe3+ + 3SO32- + 6H2O![]() 2Fe(OH)3↓+ 3H2SO3
2Fe(OH)3↓+ 3H2SO3
D. 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3H2ONH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是( )
①适当升高温度②加入NH4Cl固体③通入NH3④加入少量盐酸
A.①②B.②③C.③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试 剂 | 编号及现象 | |
试 管 | 滴 管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
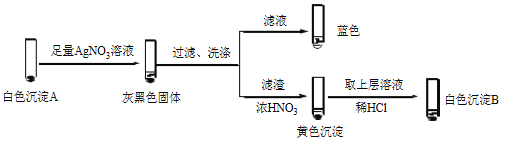
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
KI溶液 |
KI溶液 AgNO3溶液 a b |
KI溶液 CuSO4溶液 c d |
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
③方案2中,Cu2+能氧化I-,而Ag+未能氧化I-。其原因一是从K值______;二是从Cu2+的反应特点______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com