
【题目】下列指定反应的方程式正确的是
A.电解氯化镁溶液:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
B.碳酸氢铵溶液中加入足量石灰水:Ca2++![]() +OH–=CaCO3↓+H2O
+OH–=CaCO3↓+H2O
C.Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液中加入稀硫酸:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,对下列现象或事实解释错误的是( )
选项 | 现象或事实 | 解释 |
A | 《淮南万毕术》中“曾青得铁则化为铜”是现代湿法冶金的基础 | 该变化是置换反应 |
B | 维生素C将食物中不易吸收的Fe3+转化为Fe2+ | 维生素C具有氧化性 |
C | 高铁酸钠(Na2FeO4)是新型消毒剂,3ClO﹣+2Fe3++10OH﹣═2 | 碱性条件下次氯酸钠的氧化性强于高铁酸钠 |
D | 熔融烧碱时,不能用石英坩埚或陶瓷坩埚 | 烧碱可以与二氧化硅发生反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是_______。(填“Ⅰ”“Ⅱ”或“Ⅲ”)
①M为钠,则实验过程中烧杯中可观察到的现象是__________________;
②观察到烧杯里产生气泡,则说明M溶于水______(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”),理由是_____________________________;
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是_______________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是________________,说明该反应属于______(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热量变化情况,选择装置Ⅱ进行实验(在甲中进行)。M为钠,则实验过程中烧杯中可观察到的现象是_________________;
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置__________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃分子中含共价键的数目为16,则该烷烃的分子式为____________,其一氯代物只有一种的烷烃的结构简式为_____________。
(2)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
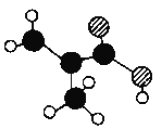
①该物质的结构简式为________________。
②下列物质中,与该物质互为同系物的是(填序号)__________,互为同分异构体的是________。
A.CH3CH=CHCOOH B.CH2=CHCOOCH3
C.CH3CH2CH=CHCOOH D.CH3CH(CH3)COOH
(3)药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
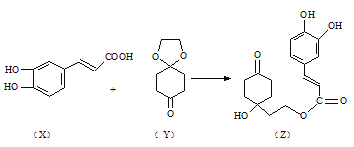
试填空:
① X的分子式为_____________ ;该分子中最多共面的碳原子数为___________ 。
②Y中是否含有手性碳原子______________(填“是”或“否”)。
③1molZ与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠______________mol;1molZ与足量的浓溴水充分反应,需要消耗Br2_____________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
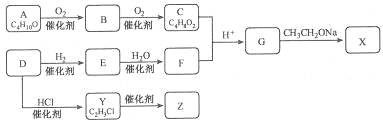
已知:①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
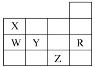
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______(已知lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
Ⅰ.A是石油裂解气的主要成分,A的产量通常是衡量一个国家石油化工水平的标准。
Ⅱ.2CH3CHO+O2→2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
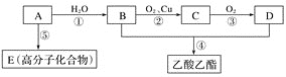
请回答下列问题。
(1)写出A的结构简式:___。
(2)B物质的名称是___。
(3)E___(填“能或不能”)使酸性高锰酸钾溶液褪色
(4)写出下列反应方程式及反应类型:
②化学方程式__,反应类型___。
④化学方程式__,反应类型___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com