
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是( )

A.每活化一个氧分子吸收0.29 eV的能量
B.水可使氧分子活化反应的活化能降低0.42 eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的反应物
【答案】C
【解析】
A.反应物的总能量高于生成物的总能量,因此每活化一个氧分子放出0.29 eV的能量,A错误;
B.化学反应过程中存在多步反应的活化能,整个反应的活化能较大者,根据能量图分析,整个反应的活化能为活化能较大者,则没有水加入的反应活化能为E=0.75 eV,有水加入的反应的活化能为E=0.57eV,所以水可使氧分子活化反应的活化能降低0.75 eV-0.57 eV=0.18 eV, B错误;
C.根据图象分析,氧分子活化过程O-O键断裂,生成C-O键,所以氧分子的活化是O-O的断裂与C-O键的生成过程,C正确;
D.活化氧可以快速氧化二氧化硫,而炭黑颗粒可以活化氧分子,因此炭黑颗粒可以看作大气中二氧化硫转化为三氧化硫的催化剂,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】1,3丙二醇是生产新型高分子材料PTT的主要原料,目前,1,3丙二醇的生产路线有:以石油裂解气为原料的两条石油化工合成路线和一条生物工程法合成路线。
(路线1)丙烯醛水合氢化法:CH2=CHCH3![]() CH2=CHCHO―→
CH2=CHCHO―→![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线2)环氧乙烷甲酰化法:
![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线3)生物发酵法:淀粉![]() 甘油
甘油![]() 1,3丙二醇
1,3丙二醇
(1)A的结构简式为_________________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是_____(填“1”、“2”或“3”),理由是___________。
(3)以1,3丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式________。
(4)已知丙二酸二乙酯能发生以下反应:
CH2(COOC2H5)2![]() CH3CH(COOC2H5)2
CH3CH(COOC2H5)2![]()
![]() 利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成
利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成![]() ,请你设计出合理的反应流程图。________
,请你设计出合理的反应流程图。________
提示①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A![]() B
B![]() C……
C……
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如下:
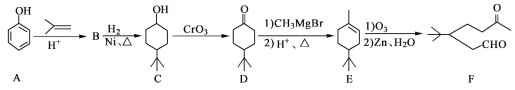
(1)化合物F中含氧官能团的名称是_________和_________。
(2)由B生成C的化学反应类型是________。
(3)写出化合物B的结构简式:__________。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:__________(任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(![]() )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物![]() 的合成路线流程图_____________________________(无机试剂任用)。
的合成路线流程图_____________________________(无机试剂任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
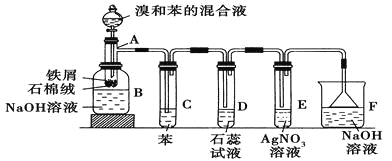
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下图所示,它可能具有的性质是( )
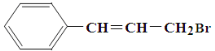
A. 能使溴水褪色,但不能使高锰酸钾酸性溶液褪色
B. 1 mol 该有机物可以与4 mol Br2加成
C. 与AgNO3溶液反应产生淡黄色沉淀
D. 在NaOH水溶液中加热可以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
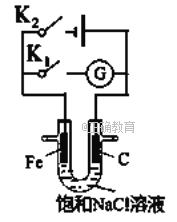
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
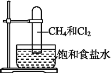
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.CH4和Cl2完全反应后液面上升,液体充满试管
D.盛放饱和食盐水的水槽底部会有少量晶体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com