
【题目】某研究小组用如图所示装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。请回答下列问题:
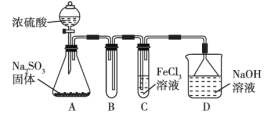
(1)通入足量SO2时C中观察到的现象为______。
(2)根据以上现象,该小组同学认为SO2与FeCl3发生了氧化还原反应。
请设计实验方案检验有Fe2+生成:____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有______(填序号)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 取少量C中反应后的溶液于试管中,向其中加入KSCN溶液,溶液不变红,再加入新制氯水,溶液变红 BC
【解析】
浓硫酸与亚硫酸钠反应生成二氧化硫气体;二氧化硫易溶于水,装置B为防倒吸装置;二氧化硫与氯化铁反应生成硫酸亚铁和氯化亚铁;二氧化硫有毒,D为尾气吸收装置。
(1)Fe3+具有强氧化性,C中发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,Fe3+显棕黄色,Fe2+显浅绿色,现象为溶液由棕黄色变成浅绿色。
(2)亚铁离子易被氧化为铁离子,则检验有Fe2+生成的实验方案是:取少量C中反应后的溶液于试管中,向其中加入KSCN溶液,溶液不变红,再加入新制氯水,溶液变红,即可说明含有亚铁离子。
(3)A.浓硫酸与SO2不发生反应,浓硫酸不能代替FeCl3溶液;
B.酸性高锰酸钾溶液具有强氧化性,能将SO2氧化,溶液紫红色褪去,说明SO2具有还原性;
C.碘水中含有I2,具有氧化性,能将SO2氧化,碘水褪色,说明SO2具有还原性;
D.NaCl溶液不与SO2发生反应,不能验证SO2有还原性。
答案为BC。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
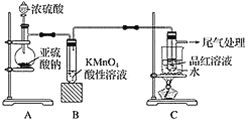
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_______。
(2)实验过程中,装置B中产生的现象为_______,这说明SO2具有____。
(3)装置C的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象:_________。
(4)尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
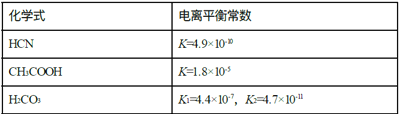
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填序号)
a NaCN溶液 b Na2CO3溶液 c CH3COONa溶液 d NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为____________。
Ⅱ.根据下列化合物:①NaOH ②H2SO4 ③CH3COOH ④NaCl ⑤CH3COONa ⑥(NH4)2SO4 ⑦CH3COONH4 ⑧NH4HSO4 ⑨NH3H2O ⑩NH4Cl,请回答下列问题:
(1)常温下,若pH均为11且等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填“<”、“>”或“=”)。
(2)已知水存在如下平衡:H2O![]() H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
H++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是____________。
A 向水中加入NaHSO4固体 B 向水中加NaHCO3固体
C 加热至100℃[其中c(H+)=1×10-6 mol·L-1] D 向水中加入NH4Cl固体
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液中,水电离的OH-浓度由大到小的顺序为(填序号)__________。
(4)物质的量浓度相同的⑥、⑦、⑧、⑨、⑩五种稀溶液中,NH4+浓度由大到小的顺序是(填序号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是( )

A.湿润的蓝色石蕊试纸先变红后褪色
B.湿润的品红试纸褪色,证明SO2具有漂白性
C.湿润的淀粉-KI试纸未变蓝,说明SO2的氧化性强于I2
D.蘸有酸性KMnO4溶液的滤纸褪色,证明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应是为了更好的利用化学反应。回答下列问题:
(1)在①置换反应 ②化合反应 ③分解反应 ④复分解反应 四种基本反应类型中,一定属于氧化还原反应的是_____________(填标号)。
(2)探究离子反应的实验装置如图。向滴有几滴酚酞的0.01 mol·L-1 Ba(OH)2溶液中逐滴滴入0.05mol·L-1 H2SO4溶液,直至过量。

①Ba(OH)2的电离方程式为__________;开始滴加0.05 mol·L-1 H2SO4时,反应的离子方程式为____________________;
②酚酞由红色变为无色时,观察到的实验现象还有____________。
(3)已知:a.向可溶性盐MnSO4的酸性溶液中加入 NaBiO3溶液,溶液变成紫红色,且有Bi3+离子生成;b.实验室常用高锰酸钾固体与浓盐酸在常温下反应制取氯气。
①写出a中反应的离子方程式________________________________;
②KMnO4、NaBiO3、Cl2的氧化性由强到弱的顺序为______________;
③某同学用盐酸酸化NaBiO3溶液,你认为是否合理,你的判定及理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.lmol·L-1H2A溶液中滴加0.lmol·L-1NaOH溶液,有关粒子物质的量的变化如图所示。下列有关说法正确的是( )

A. H2A在水中的第一步电离的电离方程式为:H2A=HA-+H+
B. c(HA-)/c(H2A)的比值随着V[NaOH(aq)]的增大而减小
C. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol·L-1
D. V[NaOH(aq)]=20mL 时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是( )
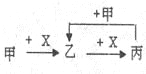
A.甲:C、X:O2
B.甲:NaOH溶液、X:CO2溶液
C.甲:Na、X:O2
D.甲:AlCl3溶液、X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com