
【题目】在 3 个体积均为 2.0 L 的恒容密闭容器中,反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度 (T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.当温度为 T1时,该反应的化学平衡常数值为 0.25
B.若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) = 0.05mol·L-1·min-1
C.达到平衡时,容器 II 中H2O的转化率比容器 I 中的小
D.达到平衡时,容器 III 中的 CO 的转化率小于 50%
【答案】C
【解析】
A. 由容器I的数据可知,当温度为 T1时,n(H2O)起始=0.5mol,n(CO)平衡=0.25mol,由于各组分的化学计量数相同,故其变化量均为0.25mol,H2O(g)的转化率为50%,因此,H2O(g)、 CO(g) 、H2(g)的平衡浓度均为0.125mol/L,该反应的化学平衡常数值K=![]() 0.125,A不正确;
0.125,A不正确;
B. 若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) =![]() 0.025mol·L-1·min-1,B不正确;
0.025mol·L-1·min-1,B不正确;
C. 容器 II中H2O(g)的投料是I的2倍,达到平衡时相当于将容器I压缩到原来的一半,化学平衡将向逆反应方向移动,H2O(g)的转化率减小,因此,容器 II 中H2O的转化率比容器 I 中的小,C正确;
D. 容器 III的投料与容器I相当(容器I中多加的0.5molC可以不考虑,因为其浓度不变),若其在T1达到平衡,CO 的转化率与I的H2O(g)的转化率之和为1,即50%;反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0,因为T1>T2,降低温度,化学平衡向逆反应方向移动,因此,达到平衡时,容器 III 中的 CO 的转化率大于 50%,D不正确;
CO(g) + H2(g) ΔH > 0,因为T1>T2,降低温度,化学平衡向逆反应方向移动,因此,达到平衡时,容器 III 中的 CO 的转化率大于 50%,D不正确;
综上所述,答案选C。


科目:高中化学 来源: 题型:
【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是( )
A | B | C | D | |
实验目的 | 制备氢氧化铁胶体 | 分离乙酸乙酯和饱和Na2CO3溶液 | 除去CO2中的少量HCl | 收集NO2 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4,回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为_____。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质A可以是__(填序号)。
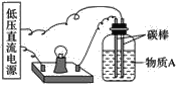
①干燥的氯化钠晶体 ②干燥的氢氧化钠晶体 ③蔗糖晶体 ④酒精 ⑤氯化钠溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧硫酸铜溶液
(2)在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是__(填字母)。
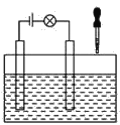
A.盐酸中逐滴加入食盐溶液 B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中滴加稀盐酸 D.硫酸中逐滴加入氢氧化钡溶液
(3)已知:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,且Ca(HCO3)2易溶于水。若在(2)题图中,电解质溶液为Ca(OH)2溶液,向溶液中逐渐通入CO2。则:下列四个图中,__(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
A.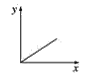 B.
B.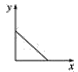 C.
C.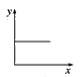 D.
D.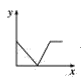
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科技工作者设计了一种电解装置,能合成氨及硝酸,实现高效人工固氮,原理如图所示下列说法正确的是
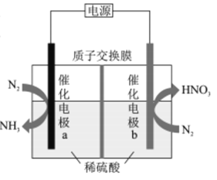
A.催化电极a的电势比催化电极b的电势高
B.负极区的电极反应为N2-10e-+6H2O=2NO3-+12H+
C.若N2得到6mole-,有6molH+向电极b迁移
D.理论上1molN2参与反应转移的电子数为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com