
【题目】用含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:

资料:i.滤液1、滤液2中部分离子的浓度(g·L-1):

ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物。
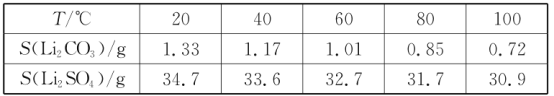
iii.某些物质的溶解度(S)如下表所示:
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是___。
(2)滤渣2的主要成分有___。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90°C下充分反应后,分离出固体Li2CO3粗品的操作是__。
(4)处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是__g。
II.纯化Li2CO3粗品
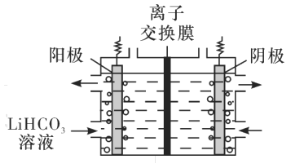
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是__,该池使用了__(填“阳”或“阴”)离子交换膜。
III.制备LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
【答案】研磨、70℃加热 Ni(OH)2、Mg(OH)2、Ca (OH)2 趁热过滤 185ab 4HCO3--4e-=4CO2↑+3O2↑+2H2O 阳 Li2CO3+2C+2FePO4![]() 2LiFePO4+3CO↑
2LiFePO4+3CO↑
【解析】
为加快含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)的酸浸速率,将其研磨粉碎,并用稀硫酸在70℃温度下溶浸,由于硫酸钙属于微溶物,经过滤,形成含有Li+、Ni2+、Mg2+、SO42-、少量Ca2+的滤液1,滤渣1中含有硫酸钙和不溶于硫酸的杂质,向滤液1中加入氢氧化钠,调节PH值为12,将Ni2+、Mg2+、少量Ca2+转化为Ni(OH)2、Mg(OH)2、Ca (OH)2,经过滤,得到主要含有Li+、SO42-和极少量Ni2+、Mg2+、Ca2+的滤液2,滤渣2中含有Ni(OH)2、Mg(OH)2、Ca (OH)2,向滤液2中加入EDTA将少量Ni2+、Mg2+、Ca2+转化为稳定的络合物,再加入饱和碳酸钠溶液将Li+转化为碳酸锂沉淀,并加热,趁热过滤,用热水洗涤分离出碳酸锂,再经过一系列操作最终制取正极材料LiFePO4,据此分析解答。
(1)根据分析和上述流程图示中为加快化学反应速率而采取的措施是研磨、70℃加热;
(2)根据分析和资料i,Ni、Mg、Ca在溶液中的浓度变化较大,滤渣2的主要成分含有Ni(OH)2、Mg(OH)2和Ca (OH)2;
(3)向滤液2中先加入EDTA,与Ni2+、Mg2+、Ca2+转化为稳定的络合物,从而确保它们不与Li+一起沉淀,再加入饱和Na2CO3溶液,90°C下充分反应后,形成碳酸锂的热饱和溶液,通过趁热过滤分离出固体碳酸锂的粗品;
(4) 处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,废渣中浸出锂的物质的量为![]() =
=![]() mol,转化为Li2CO3的锂的物质的量为
mol,转化为Li2CO3的锂的物质的量为![]() mol,根据锂元素守恒,则碳酸锂的物质的量为
mol,根据锂元素守恒,则碳酸锂的物质的量为![]() mol,则粗品中含Li2CO3的质量是
mol,则粗品中含Li2CO3的质量是![]() mol ×74g/mol=185abg;
mol ×74g/mol=185abg;
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液,HCO3-要参与电极反应转化为二氧化碳,才能制备高纯度的LiOH,根据电解原理,阳极发生氧化反应,且阳极的电极反应式是4HCO3--4e-=4CO2↑+3O2↑+2H2O;Li+移向阴极生成LiOH,该池使用了阳离子交换膜;
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,由质量守恒,可燃性气体应是一氧化碳,该反应的化学方程式是Li2CO3+2C+2FePO4![]() 2LiFePO4+3CO↑。
2LiFePO4+3CO↑。


科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列有关曲线与对应的叙述正确的是
时,下列有关曲线与对应的叙述正确的是
A. 如图可表示体积均为
如图可表示体积均为![]() L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
B. 如图可表示水溶液中
如图可表示水溶液中![]() 与
与![]() 的浓度变化曲线,则升髙温度可实现
的浓度变化曲线,则升髙温度可实现![]()
C. 如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与
如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与![]() gZn反应,则a表示盐酸
gZn反应,则a表示盐酸
D. 如图可表示体积为
如图可表示体积为![]() 1
1![]() 盐酸用水稀释至VL情况,则
盐酸用水稀释至VL情况,则![]() 范围内:
范围内:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的个数是
①含氧的化合物一定是氧化物
②盐的组成中一定含有金属元素
③![]() 一元酸溶液中
一元酸溶液中![]() 浓度一定为
浓度一定为![]()
④强酸溶液中的![]() 浓度一定大于弱酸溶液中的
浓度一定大于弱酸溶液中的![]() 浓度
浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥![]() 水溶液电离时生成的阳离子有氢离子,所以是酸
水溶液电离时生成的阳离子有氢离子,所以是酸
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、
、![]() 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:![]() 某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温
某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
| NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______ ![]() 保留两位小数
保留两位小数![]() .
.
②![]() 后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(2)用![]() 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①![]()
②![]()
③![]()
写出![]() 与
与![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 的热化学方程式 ______
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的![]() ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用![]() 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为 ______ ![]() 写出一种即可
写出一种即可![]() .
.
②若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈 ______ 性
恰好完全反应生成正盐,则此时溶液呈 ______ 性![]() 填“酸”或“碱”
填“酸”或“碱”![]() .
.![]() 已知常温下:氨水
已知常温下:氨水![]() ,
,![]()
![]() ,
,![]() .
.![]()
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图.催化剂b表面发生的电极反应式为 ______
的原理示意图.催化剂b表面发生的电极反应式为 ______ ![]() 常温下,
常温下,![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______ .
______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com