
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
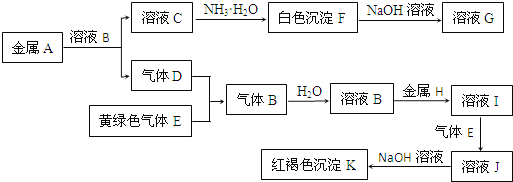
(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
【答案】Al H2 Fe(OH)3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al(OH)3+ NaOH=NaAlO2+2H2O 先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀
【解析】
K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3。据此解答。
(1)根据以上分析可知A是Al,D是H2,K是Fe(OH)3;
(2)反应“C→F”的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应“F→G”的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O;
(4)FeCl2中滴入NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+4H2O=4Fe(OH)3。因此实验现象是先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6 mol/L的稀硫酸,其他试剂任选。

请回答下列问题:
(1)B装置中盛有一定量的NaOH溶液,A装置中应预先加入的试剂是________,A装置中发生反应的离子方程式是___________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述制取Fe(OH)2的操作过程__________________。
(4)实验完毕,拔去B装置中的橡胶塞,放入一部分空气,此时B装置中发生反应的化学方程式为_______________________。
(5)在下图中,装置________(填序号)能较长时间观察到Fe(OH)2白色沉淀。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________;C、D两种元素所形成的简单离子,离子半径由大到小的顺序是________________。(用离子符号表示)
(2)写出A2C2的电子式__________。
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为________。一段时间后达到平衡,下列说法正确的是__________。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:___________。
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示,下列说法不正确的是

A. 该电池在高温下工作的速度更快
B. HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-= SO42-+9H+
C. b是电池的负极
D. 若该电池有0.45 mol 电子转移,则有0.45 mol H+向左通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在紫外线的作用下,氧气可生成臭氧:3O2![]() 2O3,一定条件下该反应达到平衡状态的标志是( )
2O3,一定条件下该反应达到平衡状态的标志是( )
A. 单位时间内生成2 mol O3,同时消耗3 mol O2
B. O2的消耗速率0.3 mol·L-1·s-1,O3的消耗速率0.2 mol·L-1·s-1
C. 容器内,2种气体O3、O2浓度相等
D. 气体密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com