
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石![]() 含有少量
含有少量![]() 、
、![]() 杂质
杂质![]() 为原料制备沉淀碳酸钙的工艺流程如下:
为原料制备沉淀碳酸钙的工艺流程如下:
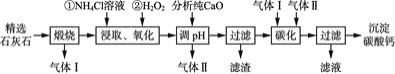
![]() 流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____
流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____![]() 填化学式
填化学式![]() 。
。
![]() “碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
“碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
![]() 工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
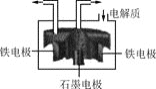
![]() 电解过程中,加入氯化钙的目的是________。
电解过程中,加入氯化钙的目的是________。
![]() 石墨电极发生的电极反应为________。
石墨电极发生的电极反应为________。
【答案】![]()
![]() 先通入气体Ⅱ
先通入气体Ⅱ![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() 降低电解质的熔融温度,降低能耗
降低电解质的熔融温度,降低能耗 ![]()
【解析】
依据流程图可知,气体Ⅰ是二氧化碳,气体Ⅱ是氨气,产生的滤液是氯化铵。
精选石灰石中含有少量MgCO3、FeCO3杂质,经过煅烧,可生成二氧化碳气体,生成的固体加入氯化铵溶液、过氧化氢,可溶解并氧化FeO生成铁离子,加入分析纯CaO
生成气体为氨气,同时生成氢氧化镁、氢氧化铁沉淀,滤液中含有氯化钙,通入氨气、二氧化碳气体,可生成碳酸钙和氯化铵,以此解答该题。
![]() 根据分析可知流程中可以循环利用的物质有气体Ⅰ是二氧化碳,气体Ⅱ是氨气、和
根据分析可知流程中可以循环利用的物质有气体Ⅰ是二氧化碳,气体Ⅱ是氨气、和![]() ;故答案为:
;故答案为:![]() ;
;
![]() “碳化”时发生反应的离子方程式为:
“碳化”时发生反应的离子方程式为:![]() ,依据气体的性质
,依据气体的性质![]() 氨气易溶于水,加入后可以提高二氧化碳的溶解度
氨气易溶于水,加入后可以提高二氧化碳的溶解度![]() ,所以该过程中通入气体Ⅰ和气体Ⅱ的顺序是先通入气体Ⅱ
,所以该过程中通入气体Ⅰ和气体Ⅱ的顺序是先通入气体Ⅱ![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() 。故答案为:
。故答案为:![]() ;先通入氨气
;先通入氨气![]() 或后通气体Ⅰ
或后通气体Ⅰ![]() ;
;
![]() 电解过程中,加入氯化钙的目的是:降低电解质的熔融温度,降低能耗。故答案为:降低电解质的熔融温度,降低能耗;
电解过程中,加入氯化钙的目的是:降低电解质的熔融温度,降低能耗。故答案为:降低电解质的熔融温度,降低能耗;
![]() 铁电极若为阳极会参与反应,所以石墨电极为阳极,发生的电极反应方程式为:
铁电极若为阳极会参与反应,所以石墨电极为阳极,发生的电极反应方程式为:![]() 。故答案为:
。故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃。某小组在实验室中拟用下图所示装置制取并收集C1O2。冋答下列问题:
(1)C1O2的制备
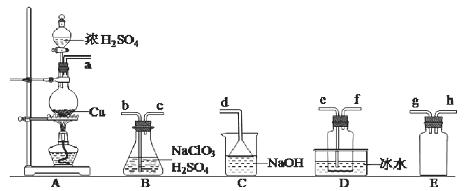
已知:SO2 +2NaClO3 +H2SO4 =2C1O2↑+2NaHSO4
①装置A中反应的化学方程式为_________________________。
②欲收集干燥的C1O2,选择上图中的装罝,其连接顺序为a→____________(按气流方向,用小写字母表示)。
③装置D的作用是_________________。
④若没有E装置,会造成的严重后果是____________________。
(2)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤2的反应中氧化产物的电子式为______。
②滴定终点的实验现象是_________________。
③原C1O2溶液的浓度为____g/L(用少骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______;若滴定开始仰视读数,滴定终点时正确读数,则测定结果_____。(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,水质优劣直接影响人体健康,水处理技术在生产、生活中应用广泛。聚合硫酸铁(PFS)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)和废铁屑为原料制取聚合硫酸铁([Fe2(OH)x(SO4)3-![]() ]m)的工艺流程如图:
]m)的工艺流程如图:
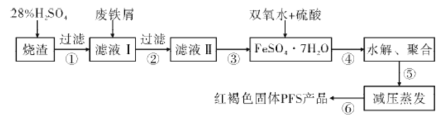
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______(填标号)。
a.容量瓶 b.烧杯 c.玻璃棒 d.分液漏斗
(2)废铁屑表面附有铁锈,铁锈的主要成分为______,步骤③的具体实验操作有____。
(3)水解、聚合要严控pH和温度。pH偏小时Fe3+水解程度弱,pH偏大时则______。写出水解、聚合反应生成PFS的化学方程式:_________。
(4)步骤⑥相对于常压蒸发,减压蒸发的优点是_________。
(5)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质能作为沉淀剂的是_______(填标号)。
a.氨水 b.硫化氢气体 c.硫酸钠溶液 d.纯碱溶液
(6)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然水中c(Ca2+)=1.5×10-3mol/L,c(Mg2+)=6.4×10-4mol/L,则此水的硬度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
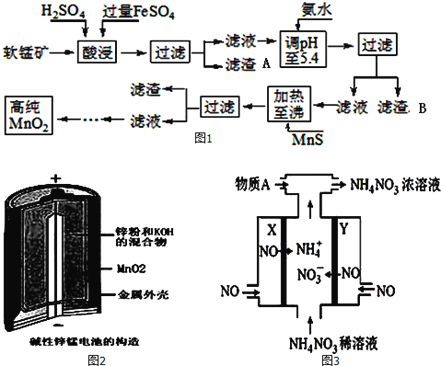
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnSe是一种光电性能优异的半导体材料,某研究小组用如图1方法制备了ZnSe.

![]() 溶于水生成
溶于水生成![]() ,下列物质与水反应,跟此反应类型相同的是 ______
,下列物质与水反应,跟此反应类型相同的是 ______
![]()
![]()
![]()
![]()
![]()
![]() 硒酸
硒酸![]() 的水溶液按下式发生一级和二级电离:
的水溶液按下式发生一级和二级电离:![]() ;
;![]() ,
,![]()
![]() 溶液显 ______
溶液显 ______ ![]() 填“酸性”、“中性”、“碱性”
填“酸性”、“中性”、“碱性”![]() .
.
![]() 向
向![]() 溶液中滴加少量氨水,该反应的离子方程式为 ______ .
溶液中滴加少量氨水,该反应的离子方程式为 ______ .
![]() 已知
已知![]() 的两级电离常数分别为
的两级电离常数分别为![]() ,
,![]() ,则
,则![]() 和
和![]() 两溶液混合后反应的离子方程式为 ______ .
两溶液混合后反应的离子方程式为 ______ .
![]() 肼
肼![]() 与
与![]() 反应的氧化产物是
反应的氧化产物是![]() 氧化剂与还原剂的物质的量之比为 ______ .
氧化剂与还原剂的物质的量之比为 ______ .
![]() 电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
电化学降解法可用于治理水中硝酸盐的污染,所得产物可直接排入大气.其原理如图2所示,其中B为电源的 ______ 极,乙池中电极反应式为 ______ ,为使反应持续进行,须适时向甲池中添加 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com