
【题目】二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如图1:
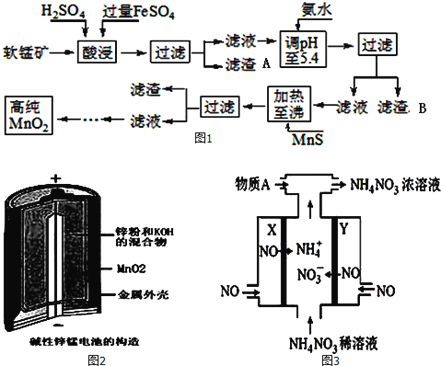
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH如表,回答下列问题
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________;
(2)滤渣A的主要成分是____________;滤渣B的主要成分是__________________;
(3)加入MnS的目的是除去Cu2+、Zn2+杂质,可能原因是_________________;
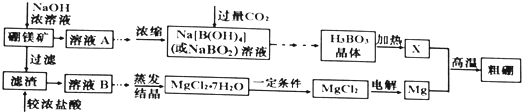
(4)碱性锌锰电池是一种一次性电池,其结构如图2所示.该电池放电过程产生MnOOH.该电池的正极反应式为________________,电池总反应的方程式为_______________________;
(5)利用该碱性锌锰电池电解NO制备NH4NO3,其工作原理如图3所示,X电极__________极,电解时阳极的电极反应为________________,使电解产物全部转化为NH4NO3,需补充物质A,A是__________;
【答案】2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O SiO2 Fe(OH)3和Al(OH)3 CuS、ZnS的溶解度较MnS小 MnO2+H2O+e-═MnOOH+OH- Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 阴 NO-3e-+2H2O=NO3-+4H+ NH3
【解析】
软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰。
(1)FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时二氧化硅不反应,滤渣A为SiO2,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣B的主要成分为Fe(OH)3和Al(OH)3;
(3)由题中硫化物的Ksp可知,加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+;
(4)在反应中Zn元素化合价升高,被氧化,Zn在负极反应,负极电极反应式为Zn+2OH--2e-═Zn(OH)2,Mn元素化合价降低,被还原,MnO2在正极反应,正极反应式为MnO2+H2O+e-═MnOOH+OH-,反应的化学方程式为:Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2;
(5)X极发生的是NO得到电子生成NH4+的反应,所以X极为阴极,Y极发生的是NO失电子生成NO3-的反应,所以Y为阳极,电极反应为NO-3e-+2H2O=NO3-+4H+,X阴极反应为:NO+5e-+6H+=NH4++H2O;使得失电子总数相等,阳极反应为5NO-15e-+10H2O=5NO3-+2OH-,阴极反应为:3NO+15e-+18H+=3NH4++3H2O,相加得总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,和总反应生成硝酸生成硝酸铵。故答案为:NO-3e-+2H2O=NO3-+4H+NH3,NH3。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,和总反应生成硝酸生成硝酸铵。故答案为:NO-3e-+2H2O=NO3-+4H+NH3,NH3。
【点晴】
流程分析是解题关键;软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰;据此解题可迎刃而解。


科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系不正确的是( )
A.物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
B.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③
D.等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硼镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 和
和![]() 制取粗硼的工艺流程为:
制取粗硼的工艺流程为:
已知:![]() 硼与铝的性质相似,也能与氢氧化钠溶液反应.
硼与铝的性质相似,也能与氢氧化钠溶液反应.
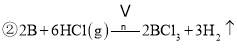
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,在潮湿空气中易形成白雾.
,在潮湿空气中易形成白雾.
I.回答下列问题:
![]() 证明溶液B中含有铁元素的方法是 ______
证明溶液B中含有铁元素的方法是 ______
![]() 与X反应制取粗硼的化学方程式 ______
与X反应制取粗硼的化学方程式 ______
![]() 上图中制取
上图中制取![]() 的“一定条件”是指 ______
的“一定条件”是指 ______
![]() 某同学设计如图所示装置制备三氯化硼.
某同学设计如图所示装置制备三氯化硼.

回答下列问题:
![]() 装置的作用是 ______ .
装置的作用是 ______ .
![]() 如果去掉B装置,可能的后果是 ______ .
如果去掉B装置,可能的后果是 ______ .

![]() 装置后面还应连接的一个装置是 ______ .
装置后面还应连接的一个装置是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石![]() 含有少量
含有少量![]() 、
、![]() 杂质
杂质![]() 为原料制备沉淀碳酸钙的工艺流程如下:
为原料制备沉淀碳酸钙的工艺流程如下:
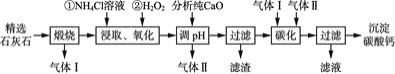
![]() 流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____
流程中可以循环利用的物质有气体 Ⅰ、气体Ⅱ和____![]() 填化学式
填化学式![]() 。
。
![]() “碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
“碳化”时发生反应的离子方程式为 ______________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________。
![]() 工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:
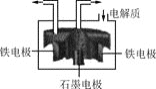
![]() 电解过程中,加入氯化钙的目的是________。
电解过程中,加入氯化钙的目的是________。
![]() 石墨电极发生的电极反应为________。
石墨电极发生的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是


A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,甲的压强比乙的压强大
3C(g)+D(s)的影响,甲的压强比乙的压强大
C.图3表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com