
【题目】常温下,向20mL0.1moL/L的H3PO4溶液中滴加0.1moL/L的 NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是

A. H3PO4溶液第一步滴定可用酚酞作指示剂
B. A点溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-)
C. 图像中A、B、C三处溶液中![]() 相等
相等
D. B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
【答案】C
【解析】
A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂;
B、NaH2PO4在水溶液中,电离大于水解;
C、温度相同,同一反应的平衡常数相同;
D、B点是Na2HPO4溶液,用物料守恒去解。
A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂,可选用甲基橙作指示剂,故A错误;
B、A点为NaH2PO4溶液,NaH2PO4在水溶液中,电离大于水解,A点溶液中c(H2PO4-)>c(HPO42-)>c(H3PO4),故B错误;
C、温度相同,同一反应的平衡常数相同,HPO42-水解常数:A、B、C三处溶液中![]() 相等,故C正确;
相等,故C正确;
D、B点是Na2HPO4溶液,物料守恒为:c(Na+)=2[c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)],故D错误。
故选C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的原子结构示意图为: ,D的最外层电子数是电子层数的2倍。试回答下列各问题:
,D的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)A的阴离子的结构示意图为_____________;
(2)C元素位于元素周期表中第________周期、第_______族;
(3)化合物B2A的电子式为______________;
(4)已知:D的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,已知:
①4Fe(s)+3O2(g)= 2Fe2O3(s) ΔH1
②4Al(s)+3O2(g)= 2Al2O3(s) ΔH2
③2Al(s)+Fe2O3(s)= Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系正确的是
A. ΔH3=![]() (ΔH1+ΔH2) B. ΔH3=(ΔH2-ΔH1)
(ΔH1+ΔH2) B. ΔH3=(ΔH2-ΔH1)
C. ΔH3=2(ΔH1+ΔH2) D. ΔH3=![]() (ΔH2-ΔH1)
(ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述不正确的是( )
A.侯德榜制得的碱是烧碱B.道尔顿提出了原子论
C.阿伏加德罗提出了分子学说D.青铜是我国最早使用的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案I:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________________。
方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池的装置图_________,标出原电池的电极材料和电解质溶液,并写出负极电极反应式负极反应式: ________________。

方案III;结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案1、II不能雷同) ________________用离子方程式表示其反应原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________,除此之外,装置的一个明显错误是___________________________________________________。

(2)NaOH溶液稍过量的原因是_______________________________________________。
(3)若改用60mL、0.25mol/L的H2SO4溶液和50mL、0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”或“不相等”),若实验操作均正确,则所求中和热_______________(填“相等”或“不相等”)。
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),则中和热△H=__________(取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g)![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
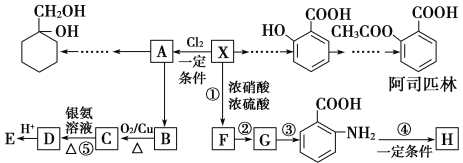
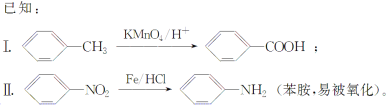
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有________个原子共面。
(2)H的结构简式为_____________________________________。
(3)反应②、④的类型分别为____________反应、____________反应。
(4)反应⑤的化学方程式是____________________________________________。
(5)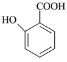 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com