
【题目】姜黄素具有搞突变和预防肿瘤的作用,其合成路线如下:
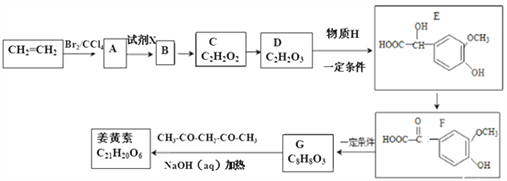
已知:①![]()
②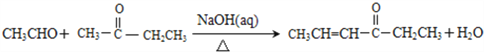
请回答下列问题:
(1)D中含有的官能团名称是___________。
(2)反应A→B的反应条件为________;已知D→E转化中原子利用率100%,则H的结构简式为______________。
(3)姜黄素的结构简式为_________________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其化学方程式为_________________________________________。
(5)下列有关E的叙述不正确的是___________(填正确答案编号)。
a.1molE与浓溴水反应最多消耗3mol的Br2
b.E能发生氧化、加成、取代和缩聚反应
c.1molE最多能与3molNaOH发生反应
d. E能与FeCl3溶液发生显色反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有__________种。
①苯环上的一取代物只有2种;②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为_________。
【答案】 醛基、羧基 氢氧化钠水溶液,加热 ![]()
![]() nHO-CH2-CH2-OH+nHOOC-COOH→
nHO-CH2-CH2-OH+nHOOC-COOH→![]() +(2n-1)H2O ac 6种
+(2n-1)H2O ac 6种 ![]()
【解析】乙烯和溴发生加成反应生成A,A结构简式为BrCH2CH2Br,A和试剂X反应生成B,B反应生成C,根据C分子式知,C为OHCCHO,则B为CH2OHCH2OH,A和NaOH的水溶液加热发生取代反应生成B,B发生氧化反应生成C,根据C、D分子式知,D为OHC-COOH,D和H反应生成E,根据E结构简式知,H为![]() ,E发生氧化反应生成F,根据F、G分子式结合信息①知,F发生消去反应生成G,G为
,E发生氧化反应生成F,根据F、G分子式结合信息①知,F发生消去反应生成G,G为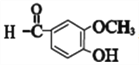 ,根据信息②知,姜黄素的结构简式为:
,根据信息②知,姜黄素的结构简式为:![]() 。
。
(1)D的结构简式为: OHC-COOH,所以D中含有的官能团名称为醛基,羧基。(2)A:(1、2-二溴乙烷),生成B:(HOCH2CH2OH),卤代烃转化生成醇,发生了水解,条件是NaOH水溶液,加热。D :(OHC-COOH)→E,转化中原子利用率100%,根据E的分子式知,H的结构简式为:![]() 。(3)根据以上分析可知姜黄素的结构简式为:
。(3)根据以上分析可知姜黄素的结构简式为:![]() 。(4)D的催化氧化产物为:HOOC-COOH, B为HOCH2-CH2OH,二者可以发生缩聚反应生成高分子化合物,其化学方程式为:
。(4)D的催化氧化产物为:HOOC-COOH, B为HOCH2-CH2OH,二者可以发生缩聚反应生成高分子化合物,其化学方程式为:
nHO-CH2-CH2-OH+nHOOC-COOH→![]() +(2n-1)H2O;(5)a、苯环上酚羟基邻对位氢原子能被溴原子取代,所以1molE与浓溴水反应最多消耗1mol的Br2,a错误;b、E中含有醇羟、羧基、苯环、醚键、酚羟基,能发生氧化反应、加成反应、取代反应和缩聚反应,b正确;c、酚羟羧基能和NaOH反应,所以1molE最多能与2molNaOH发生反应,c错误;d、E中含有酚羟基,所以E能与FeCl3溶液发生显色反应,d正确。答案选ac;(6)G为
+(2n-1)H2O;(5)a、苯环上酚羟基邻对位氢原子能被溴原子取代,所以1molE与浓溴水反应最多消耗1mol的Br2,a错误;b、E中含有醇羟、羧基、苯环、醚键、酚羟基,能发生氧化反应、加成反应、取代反应和缩聚反应,b正确;c、酚羟羧基能和NaOH反应,所以1molE最多能与2molNaOH发生反应,c错误;d、E中含有酚羟基,所以E能与FeCl3溶液发生显色反应,d正确。答案选ac;(6)G为 ,G的同分异构体符合下列条件:①苯环上的一取代物只有2种说明苯环上只有两种氢原子;②1mol该物质与烧碱溶液反应,最多消耗3molNaOH,这说明含有3 个酚羟基和乙烯基,或水解后的产物含有2 个酚羟基和1 个羧基,符合条件的有
,G的同分异构体符合下列条件:①苯环上的一取代物只有2种说明苯环上只有两种氢原子;②1mol该物质与烧碱溶液反应,最多消耗3molNaOH,这说明含有3 个酚羟基和乙烯基,或水解后的产物含有2 个酚羟基和1 个羧基,符合条件的有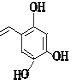 、
、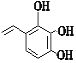 、
、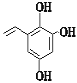 、
、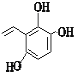 、
、![]() 、
、![]() ,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为
,其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】学习了铜与浓硫酸的反应后,某班同学用如下实验探究Mg与浓硫酸反应的气体产物。回答下列问题:
(1)足量Mg与浓硫酸反应

①Mg与浓硫酸反应的气体制备装置可选择上图中的_______,由Cu与浓硫酸的反应可知Mg与浓硫酸反应的主要化学方程式为____________________________。
②设计实验验证Mg与浓硫酸反应的主要气体产物的方法:____________________________。
(2)Mg与浓硫酸反应杂质气体的探究

①随着Mg与浓硫酸的反应进行,逐渐产生一种还原性气体,该气体是__________(写化学式)。
②为探究这种气体的存在,可采用上述组合后的装置,装置连接顺序是__________________→F,其中装置F的玻璃管中盛有的固体药品名称是_____________________,该装置中干燥管内的碱石灰的作用是_____________________。
③装置B的现象是_____________________。
④装置C的作用是__________________________。
⑤装置E中发生反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______。

(3)Mg是第三周期元素,该周期部分元素氟化物的熔点下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常以铝土矿(主要成分为Al2O3,含有少量Fe2O3、SiO2等杂质)为原料制备无水氯化铝:2Al2O3+6Cl2===4AlCl3+3O2。
回答以下问题:
(1)为促进反应的进行,实际生产中需加入焦炭,其原因是____________________。
(2)加入焦炭后的化学反应可表示为Al2O3+C+Cl2△,AlCl3+X↑,则气体X可能是
___________________________________________________________。
(3)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为________________。
(4)以铝土矿为原料可以通过以下途径提纯氧化铝:

①写出滤液甲中溶质的化学式:______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5g HCl溶解在1L水中(水的密度近似为1g· mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度:c=1 mol·L-1 B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L D. 所得溶液的质量分数:w=36.5c/(1000ρ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A. 氢氧化铝可以用于治疗胃酸过多 B. Fe3O4可用作红色油漆和涂料
C. 金属钠有强还原性,能和硫酸铜溶液反应,但不能置换出金属铜 D. 为使面包松软可口可用碳酸氢钠做发泡剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C。下列物质含有丰富维生素C的是____________(填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素
是_________( 填字母)
A.碘 B.铁 C.钙
③蛋白质是人体必需的营养物质,它在人体内最终分解为___________(填字母)。
A.葡萄糖 B.氨基酸 C.脂肪酸
(2) 材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①居室装修所使的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 __________(填字母)。
A.酒精 B.蔗糖 C.甲醛
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为_________________________________________________________________。
(3) 保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。对汽车加装尾气催化净化装置,可以使其中的NO、CO相互反应转化成无毒的气体,其原理可以用化学方程式表示为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg ![]() MgCl2+2Rb(g),下列说法正确的是
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A. 过氧化钠可用于潜水艇的氧气来源 B. 氯气可用于制农药 C. 纯碱可用于治疗胃酸过多 D. 钠可用于冶炼金属钛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com