
����Ŀ��ij��A����Է�������Ϊ28������ʹ������Ȼ�̼��Һ��ɫ��F�߷��ӻ������������ת����ϵ�� 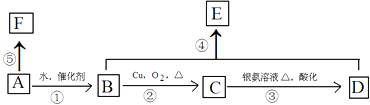
��Ҫ����գ�
��1��д��C�����������ŵ����� �� ָ���ܵķ�Ӧ���� ��
��2����Bת��ΪA�����跴Ӧ����Ϊ�� ��
��3��д��B��F�ṹ��ʽ��B��F ��
��4��д����Ӧ�۶�Ӧ�Ļ�ѧ����ʽ�� ��
��5��д����Ӧ�ܶ�Ӧ�Ļ�ѧ����ʽ�� ��
��6��E��ͬ���칹���ж��֣���������NaHCO3��Ӧ��ͬ���칹�干���֣�
���𰸡�
��1��ȩ����������Ӧ��ȡ����Ӧ
��2��Ũ���ᡢ170��
��3��CH3CH2OH��![]()
��4��2CH3CHO+O2 ![]() 2CH3COOH
2CH3COOH
��5��CH3COOH+HOC2H5 ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
��6��2
���������⣺��A����Է�������Ϊ28������ʹ������Ȼ�̼��Һ��ɫ����AΪCH2=CH2 �� ��ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ���������������CΪCH3CH2O����ȩ��һ������������Ӧ����DΪCH3COOH���������Ҵ�����������Ӧ����EΪCH3CH2OOCH2CH3 �� F�߷��ӻ��������ϩ�����Ӿ۷�Ӧ����FΪ ![]() ��
��
��1.��CΪCH3CH2O��C�����������ŵ�����ȩ�����ܵķ�Ӧ����Ϊ������Ӧ��ȡ����Ӧ��
���Դ��ǣ�ȩ����������Ӧ��ȡ����Ӧ��
��2.����Bת��ΪA���Ҵ�������ȥ��Ӧ������ϩ�����跴Ӧ����Ϊ��Ũ���ᡢ170�棬
���Դ��ǣ�Ũ���ᡢ170�棻
��3.��B�Ľṹ��ʽΪCH3CH2OH��F�Ľṹ��ʽΪ ![]() ��
��
���Դ��ǣ�CH3CH2OH�� ![]() ��
��
��4.����Ӧ����ȩ�������������ᣬ��Ӧ����ʽΪ��2CH3CHO+O2 ![]() 2CH3COOH�����Դ���2CH3CHO+O2
2CH3COOH�����Դ���2CH3CHO+O2 ![]() 2CH3COOH��
2CH3COOH��
��5.����Ӧ���������Ҵ�����������Ӧ����������������Ӧ����ʽΪ��CH3COOH+HOC2H5 ![]() CH3COOC2H5+H2O��
CH3COOC2H5+H2O��
���Դ��ǣ�CH3COOH+HOC2H5 ![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
��6.��EΪCH3CH2OOCH2CH3��ͬ���칹������NaHCO3��Ӧ��˵�������Ȼ������Կ������鱻��COOHȡ����ͬ���칹��Ľṹ��ʽΪ��CH3CH2CH2COOH����CH3��2CHCOOH�����Դ��ǣ�2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ���ḻ���ʱ��⣬ͨ����ˮ���ۺ����ÿɻ���������ʹ�����ʹ�ã�
��1����ˮ���εĿ������ã�
�ٺ�ˮ����Ŀǰ�����Ϊt�����������ѡ��Զ�뽭���뺣�ڣ�������꣬��ϫ��������ƽ̹�տ��ĺ�̲�����������Ϊ��ˮ�ء������غ��أ�
��Ŀǰ��ҵ�ϲ��ñȽ��Ƚ������ӽ���Ĥ���۷������ȼҵ�������ڵ����������ӽ���Ĥֻ����������ͨ������ֹ�����Ӻ�����ͨ������˵���ȼ������������ӽ���Ĥ�����ã���дһ�㼴�ɣ���
��2�����������ǽ��귢չ���һ�ֽϺõĺ�ˮ������������ԭ����ͼ��ʾ�����о���ѡ���Ե������ӽ���Ĥ�������ӽ���Ĥ������У���ش���������⣺
�ٺ�ˮ����ֱ��ͨ�˵��������У������� ��
��A���ų����������ˮ����Ũˮ����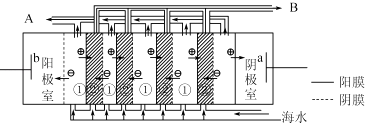
��3���ÿ�±����Na+��K+��Mg2+��Cl����Br�������ӣ�����ȡ�壬�������������� 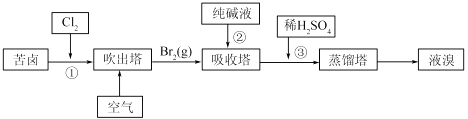
�����������е���Һ��BrO3�� �� ���������з�Ӧ�����ӷ���ʽΪ��
��ͨ�����Ȼ��ѻ�ú�Br2����Һ��Ϊ�λ��辭�����������ա��ữ���»�ú�Br2����Һ�� ��
������������ͨ��ˮ�������ȣ������¶���90�����ҽ��������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼����Ļ���������ʣ������ں�����������ЧӦ��������Ⱦ�����ܽ�����Դ�����ã��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1���п�ѧ�����������FeO���պ�����CO2 �� ����Ȼ�ѧ����ʽ���£� 6FeO��s��+CO2��g���T2Fe3O4��s��+C��s����H=��76.0kJmol��1
��������Ӧ�Ļ�ԭ����Ϊ �� ÿ����1mol Fe3O4 �� ת�Ƶ��ӵ����ʵ���Ϊmol��
����֪��C��s��+2H2O��g���TCO2��g��+2H2��g����H=+113.4kJmol��1 �� ��Ӧ��
3FeO��s��+H2O��g���TFe3O4��s��+H2��g���ġ�H= ��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�CO2��g��+4H2��g��CH4��g��+2H2O��g������һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2 �� ��300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2 0.2molL��1 �� H2 0.8molL��1 �� CH4 0.8molL��1 �� H2O 1.6molL��1 �� ��300��ʱ������Ӧ��ƽ�ⳣ��K= �� 200��ʱ�÷�Ӧ��ƽ�ⳣ��K=64.8����÷�Ӧ�ġ�H�������������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����ú�����ͭ�Ĺ�ҵ��Һ�Ʊ�����泥��������£�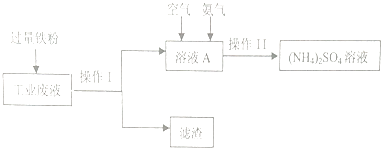
��1�������������Ϊ �� �����ijɷ�Ϊ ��
��2����ҵ��Һ�м������������������Ӧ�����ӷ���ʽΪ ��
��3��������õ��ģ�NH4��2SO4��Һ��������Ũ������Ҫ���������˾ƾ��ơ�����̨���������⣬����Ҫ ��
��4����ͼ��ҺA�з�����Ӧ�����ӷ���ʽΪ4Fe2++O2+8NH3+10H2O=8NH4++4Fe��OH��3���÷�Ӧ�Ƿ�Ϊ������ԭ��Ӧ����ǡ�����
��5�����飨NH4��2SO4��Һ�к���SO ![]() �ķ���Ϊ ��
�ķ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ƥ���һ����(����)
A. ˮ��������Na2SO4 B. С�մ�����NaHCO3 C. ʯ������CaSiO3 D. ��������FeSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H����Ҫ���л������E��F��һ�������ºϳɣ������ַ�Ӧ������ʡ�ԣ�����ע���ͷ��ָ���� 
��֪������Ϣ��
i��A���ڷ�������H����������
ii��I�ĺ˴Ź�������Ϊ����壬�ҷ�������Ϊ6��1��
�ش��������⣺
��1��D�ĺ������������� �� B�Ľṹ��ʽ ��
��2��B��C��G��J�����ķ�Ӧ���� �� ��
��3����E+F��H�Ļ�ѧ����ʽ ��
��I��G �Ļ�ѧ����ʽ ��
��4��H��ͬϵ��K��H��Է�������С28��K�ж���ͬ���칹�壮
��K��һ��ͬ���칹���ܷ���������Ӧ��Ҳ��ʹFeCl3��Һ����ɫ��������������֧���������ϵ���ĺ˴Ź�������Ϊ����壬�ҷ������Ϊ1��1��д��K������ͬ���칹��Ľṹ��ʽ ��
����K��ͬ���칹������ڷ����廯������ܺͱ���NaHCO3��Һ��Ӧ�ų�CO2 �� �������������ͬ���칹�干���֣������������칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؼ�����(Rb)�������У���ȷ���ǣ� ��
A. �����Ȼ��ʱ������û��������ɫ
B. ����������ӻ����������ˮ
C. ���ơ��ء�����ֵ����У�卑��۵����
D. �������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ����
A. ���³�ѹ�£�18gH2O�к���ԭ����ΪNA
B. ��״���£�5.6L���Ȼ�̼�к��е���ԭ����ΪNA
C. �����£�1mol��L-1NaClO��Һ�к��е���������ΪNA
D. ��״���£�14gCO��N2�Ļ�������к��е�ԭ����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ���Ͻ�Ͷ��100mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣮��������Һ�еμ�Ũ��Ϊ5mol/L��NaOH��Һ�����ɵij����������NaOH��Һ�������ϵ��ͼ���������������λ��mL��������������λ��g�� 
��
��1������NaOH��Һ0����20mL�����з�Ӧ�����ӷ���ʽΪ��������Al��OH��3������Ϊg��
��2���Ͻ���Mg������Ϊ������HCl�����ʵ���Ũ��Ϊmol/L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com