
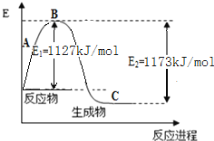
【题目】某反应过程能量变化如图所示,下列说法正确的是( )

A.该反应为放热反应,热效应ΔH=E1-E2
B.有催化剂条件下,反应的活化能等于E1+E2
C.使用催化剂后,整个反应的速率快慢由E2对应反应决定
D.曲线b说明催化剂参与反应过程,降低反应的活化能,但不改变ΔH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)![]() 2C(g)达到平衡状态的是( )
2C(g)达到平衡状态的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的总物质的量不再改变
A.②④⑤⑥B.①③④⑥C.①②④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源(锌铜硫酸原电池)使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A.铜片为负极B.锌片上发生还原反应
C.其能量转化的形式主要是“化学能→电能→光能”D.如果将稀硫酸换成盐酸,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A.CH2=CH2 + Br2→CH2BrCH2Br
B.2CH3CH2OH +O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
C.CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
D.CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
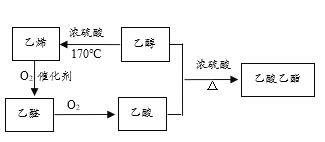
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下难溶盐AgCl的饱和溶液中,![]() 与
与![]() 的物质的量浓度类似于水中
的物质的量浓度类似于水中![]() 和
和![]() 的关系,即
的关系,即![]() 常数),在下列溶液中:
常数),在下列溶液中:
a.![]()
![]() 溶液
溶液
b.![]()
![]() 盐酸
盐酸
c.![]()
d.![]() 溶液
溶液
则AgCl的溶解度由大到小的顺序为( )
A.abcdB.cbadC.dcabD.cbda
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
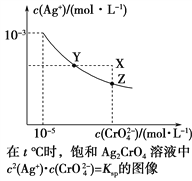
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取粗碘的某种工艺流程如图所示(部分操作名称已省略)。
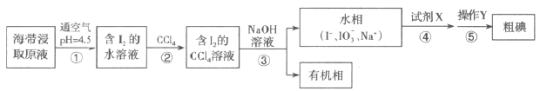
下列有关说法错误的是( )
A.步骤②的操作是萃取
B.步骤③的NaOH是还原剂
C.步骤④的试剂X是稀硫酸
D.步骤⑤的操作Y是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得5g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5 kJ的热量。试写出甲醇燃烧的热化学方程式:___________________________。
(2)现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化示意如图。根据下列已知键能数据计算N-H键键能为____________________kJ/mol 。
化学键 | H-H |
|
键能(kJ/mol) | 436 | 946 |
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
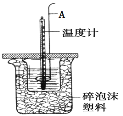
仪器A的名称为 ________________________ 。
取30mLH2SO4(0.5mol·L-1)溶液与50mLNaOH(0.5mol·L-1)溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃,已知中和后生成的溶液的比热容为![]() ,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
,溶液的密度均为1g/cm3,通过计算可得中和热 ______ 。(保留小数点后一位)
上述实验数值结果与57.3kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
实验中若改用60mLH2SO4(0.25mol·L-1)溶液与50mLNaOH(0.55 mol·L-1)溶液进行反应,与上述实验相比,所放出的热量 ______ (填“相等”、“不相等”),所求中和热 _____ (填“相等”、“不相等”),若用50mL0.5mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ______ (填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com