
将一定量的PH3和H2的混合气体,依次通过两支加热的硬质玻璃管,第一支装有足量的铜屑,第二支装有足量的CuO。第一支玻璃管中因发生反应:2PH3+3Cu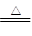 Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
Cu3P2+3H2而增重4.96 g;第二支玻璃管反应后质量减轻了5.76 g。
试求:原混合气体中PH3与H2的体积比。
4∶3
解析试题分析:设原混合气体中PH3、H2的物质的量分别为x,y,第一支玻璃管中生成H2的物质的量为z,则
2PH3+3Cu Cu3P2+3H2 反应前后固体增加的质量Δm
Cu3P2+3H2 反应前后固体增加的质量Δm
2 mol 3 mol (64×3+31×2-64×3)="62" g
x z 4.96 g
解得x=0.16 mol,z=0.24 mol。
CuO+H2 Cu+H2O 反应前后固体减轻的质量Δm
Cu+H2O 反应前后固体减轻的质量Δm
1 mol (64+16 )-64="16" g
(y+0.24)mol 5.76 g
解得y=0.12 mol。
对气体来说,同温同压下气体的体积比等于它们物质量的比。所以原混合气体中PH3和H2的体积比为:0.16:0.12=4:3
考点:考查差量法在化学计算中的应用的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为 mol/L。
②若实验室配制450mL1.19 mol/L的稀盐酸,需用该浓盐酸________ mL,如下图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。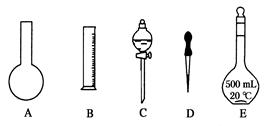
在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度____1.19mol/L (填“大于”“等于”或“小于”,下同)。若盐酸溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_______1.19mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
| KOH | O3 | A | KOH·H2O | 气体密度 |
| 16.8 g | 0.3 mol | a g | b g | >1.429 g/L |
| 16.8 g | 0.2 mol | a g | b g | 1.429 g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| | 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
①产生的氢气的体积为_________mL(标准状况下)。
②将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量 mol。
(2)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
Nierite的化学式为___________。T的化学式为____________。
(3)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | _________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,假设反应的还原产物只有NO,若实验中生成的NO气体体积及所得剩余固体的质量记录如下(所有体积均在标准状况下测定):
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| 硝酸溶液体积 | 100 mL | 200 mL | 300 mL | 400 mL | 500 mL |
| 剩余固体的质量 | 17.2 g | 8 .0g | 0 g | 0 g | 0 g |
| 气体体积 | 2.24 L | 4.48 L | 6.72 L | 7.84 L | 7.84 L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)NA为阿伏加德罗常数。25℃时,1g水中含H+离子个数约为__________NA。
(2)通过氨的催化氧化法制取硝酸,在此全过程中,理论上氨与所耗氧气的物质的量比为__________,这样所得硝酸的质量分数为_____________。
(3)往含0.2 mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5 mol。请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图。(不计弱电解质的电离和盐的水解)
(4)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为0.4, 480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1的H2SO4溶液,其操作可分为以下各步:
| A.用量筒取 mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌 |
| B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里 |
| C.将稀释后H2SO4溶液小心倒入100mL容量瓶里 |
| D.检查100mL容量瓶口部是否会发生滴漏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com