
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g·mol-l | 32 | 34 | / |
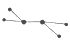 ,则X的化学式为 .
,则X的化学式为 .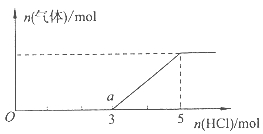
(1)N2H4;(2)acd;(3)①1;②3.0×10-6mol·L-1;
(4)①Na2S和NaOH;②c(Na+)>c(Cl—)>c(HS—)>c(OH—)>c(H+)>c(S2-)。
解析试题分析:根据题意知,X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,X常用作火箭推进剂,结合X分子的结构模型判断,X为N2H4,Y分子中含有的原子个数为4,相对分子质量为34 ,则Y为H2O2;Z的化学式可用H2A表示,则Z为H2S。(1)根据上述分析知,X的化学式为N2H4;(2)Y为H2O2,化学性质为a.不稳定性c.氧化性 d.还原性,选acd;(3)Z为H2S,将一定量的H2S气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应生成硫化铜沉淀和硫酸。①反应后溶液中氢离子浓度为0.1mol·L-1,pH=1;②若反应后溶液中c(S2-)=2.0×10-30mol·L-1,根据Ksp(CuS)=c(Cu2+)c(S2-)=6.0×10-36计算,则溶液中c(Cu2+)=3.0×10-6mol·L-1;(4)根据题给图像结合反应Na2S+HCl==NaHS+NaCl,NaHS+HCl==NaCl+H2S分析知,①O点溶液中所含溶质的化学式为Na2S和NaOH;②由图像可知,a点溶液为NaCl和NaHS混合液且氯化钠的浓度大于硫氢化钠的浓度,溶液呈碱性,硫氢根离子的水解程度大于电离程度,该溶液中离子的物质的量浓度由大到小的顺序是c(Na+)>c(Cl—)>c(HS—)>c(OH—)>c(H+)>c(S2-)。
考点:考查物质推断及相关物质的性质、沉淀溶解平衡及化学反应图像、离子浓度大小比较。


科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是________________、________________,反射炉内生成炉渣的主要成分是________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是________________、________________;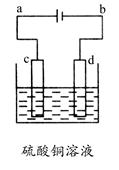
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为________________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某些化学反应可用下式表示 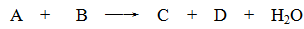
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;②当B是NaOH时,C是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。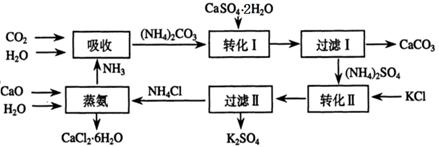
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要______________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为_____________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是_____________________________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
除去下列物质中的杂质(括号内代表杂质),请写出相应的实验方法或试剂名称及有关反应的化学方程式。
(1)NaCl溶液(Na2CO3) 试剂____________,反应的化学方程式__________________________;
(2)NaHCO3溶液(Na2CO3) 试剂____________,反应的化学方程式___________________________;(3)Na2CO3固体(NaHCO3) 实验方法____________,反应的化学方程式_____________________;
(4)铁粉(铝粉)试剂______________,反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):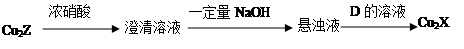
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com