
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):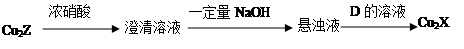
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
26.(14分,每空2分)
(1)第3周期第ⅥA族
(2)碱 C
(3)①C6H12O6 ②Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
(4)9×10-4 mol/(L·S) 4.05×104 L/mol (不写单位不扣分)
解析试题分析:
(1)Z元素是硫元素,在周期表中的位置是第3周期第ⅥA族。Y是所在周期中金属性最强的,Y是钠元素,X是氧元素,
(2)Y2ZX3是Na2SO3溶液,强碱弱酸盐水解溶液呈碱性,当在此溶液中加入BaCl2溶液后,平衡逆向移动,碱性减弱,酚酞颜色变浅。
(3)① D是纤维素水解的最终产物应该是葡萄糖,化学式是C6H12O6 。
② Cu2X与浓硝酸反应有红棕色气体生成,红棕色气体是二氧化氮,说明发生了氧化还原反应,则化学反应方程式是Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
(4)根据三态法计算模式:2SO2 + O2 2 SO3
2 SO3
开始(mol·L-1) 0.04 0.02 0
转化(mol·L-1) 0.036 0.018 0.036
平衡(mol·L-1) 0.004 0.002 0.036
v(X2) =0.018/20=9×10-4 mol/(L·S) 化学平衡常数K=0.0362/(0.0042 *0.002) = 4.05×104
考点:考查元素周期表中物质的推断,新情景下氧化还原方程式的书写,化学反应速率,化学平衡常数计算等知识。


科目:高中化学 来源: 题型:填空题
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g·mol-l | 32 | 34 | / |
 ,则X的化学式为 .
,则X的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系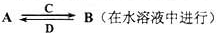
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式 ;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 . A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平)。
按要求回答下列问题:
(1)X2、Y2可能的组合是__________________。
a.F2、Br2 b.I2、Cl2 c.C12、O2 d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:___________________[用(1)中所选的X2、Y2回答,下同]。判断HXO3+HX能否反应:___________(填“能”或“不能”)。若能反应,请写出其化学反应方程式,若不能反应,请说明理由:____________________。
(3)若用KX制取HX,不能选用浓硫酸的原因是________________________。(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______________________。
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量l mol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液。则生成的沉淀C的成份是(填化学式)____________________。E溶液中阳离子除H+外,另外的阳离子的检验方法是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某些化学反应可用下式表示(未配平):A+B→C+D+H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,写出该反应的离子方程式:___________________________________________。
(2)若C为氯化钠,D是能使澄清石灰水变浑浊的无味气体,则A与B的组合是(填俗名):A________________或________________ , B______________________。
(3)若A为紫红色金属,D为无色刺激性气体,请写出符合上式的化学方程式:____________________________________________。
(4)若C、D均为气体且分子具有相同的原子个数比,则符合上式化学方程式是:____________________________________________。
(5)若A为过氧化钠,B为硫酸,则C是____________,D是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。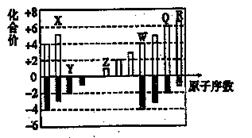
(1)元素Q位于周期表中第 周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是 。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为 。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X?Y?Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13?下列判断正确的是
| A.Y元素位于第2周期 | B.Y?Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ>HnX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com