
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系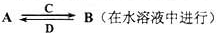
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式 ;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 . A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
(1)Na>Al>C>O>H(2) 乙醛 5CH3CHO+2MnO4-+6H+==5CH3COOH+2Mn2++3H2O (3) O=C=O ①AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3 H2O+CO2="2" Al(OH)3↓+CO32-
②CO32-+H2O HCO3-+OH-,c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+),NaCl,NaHCO3,CO2 。
HCO3-+OH-,c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+),NaCl,NaHCO3,CO2 。
解析试题分析:(1)根据题意可知这五种元素分别是:X:H; Y:C; Z:O; Q:Na; R:Al;对于电子层数相同的元素来说,元素的核电荷数越大,原子半径越小;对于电子层不同的元素来说,层数越多,原子半径越大。所以这五种元素的原子半径的大小顺序是:Na>Al>C>O>H.(2)X,Y,Z形成的既含极性键又含非极性键,且相对分子质量最小的物质是乙醛,它和酸性高锰酸钾溶液反应的离子方程式是:5CH3CHO+2MnO4-+6H+==5CH3COOH+2Mn2++3H2O。(3)C是CO2。其结构式是O=C=O①如果A,B均由三种元素组成,B为两性不溶物,则A是NaAlO2,B是Al(OH)3.由A转化为B的离子方程式AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2 AlO2-+3 H2O+CO2="2" Al(OH)3↓+CO32-.②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性则A是Na2CO3,B是NaHCO3. A溶液显碱性的原因是CO32-+H2O HCO3-+OH- A,B浓度均为0.1mol/L的混合溶液中,Na2CO3水解程度大于NaHCO3,所以c(HCO3-)> c(CO32-)。水解的溶液都显碱性,所以c(OH-) >c(H+),但盐水解的程度是很微弱的,所以c(CO32-) >c(OH-)。故混合溶液中离子浓度由大到小的顺序是c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+)。常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl,NaHCO3,CO2 。
HCO3-+OH- A,B浓度均为0.1mol/L的混合溶液中,Na2CO3水解程度大于NaHCO3,所以c(HCO3-)> c(CO32-)。水解的溶液都显碱性,所以c(OH-) >c(H+),但盐水解的程度是很微弱的,所以c(CO32-) >c(OH-)。故混合溶液中离子浓度由大到小的顺序是c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+)。常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl,NaHCO3,CO2 。
考点:考查元素、化合物的推断及化学性质和相互转化的知识。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
除去下列物质中的杂质(括号内代表杂质),请写出相应的实验方法或试剂名称及有关反应的化学方程式。
(1)NaCl溶液(Na2CO3) 试剂____________,反应的化学方程式__________________________;
(2)NaHCO3溶液(Na2CO3) 试剂____________,反应的化学方程式___________________________;(3)Na2CO3固体(NaHCO3) 实验方法____________,反应的化学方程式_____________________;
(4)铁粉(铝粉)试剂______________,反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
喷泉是一种常见的实验现象(如下图),其产生原因是存在压强差。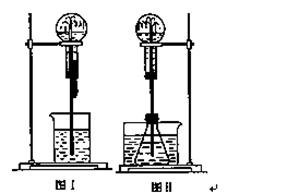
(1)图Ⅰ为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是(填编号字母) 。
A.HCl 和H2O B.O2和H2O
C.SO2和NaOH溶液 D.CO2和NaOH溶液
(2)某学生积极思考产生喷泉的其他办法,并设计了图Ⅱ所示的 装置。
在图Ⅱ的锥形瓶中,分别加入足量的下列物质,反应后可能产生 喷泉的是(填编号字母) 。
A.CaCO3和稀H2SO4 B.NaOH与稀HCl
C.Zn与稀HCl D.NaCl与稀HNO3
(3)比较图Ⅰ和图Ⅱ两套装置,从产生喷泉的原理分析,二者的不同点在于 。
(4)城市中常见的人造喷泉及火山爆发的原理与上述(填“图Ⅰ”或“图Ⅱ”)装置的原理相似。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在短周期主族元素中:
(1)由两种元素组成的化合物种类最多,其中最简单化合物的电子式为 。
(2)元素D的氢化物与D的最高价氧化物对应水化物化合得到的物质是(填化学式)__________;D的氢化物的水溶液常温下pH_____7(填“>”、“<”、“=”);D的最高价氧化物对应水化物的浓溶液与试管中足量铜片反应,开始产生有色气体,一段时间后则产生无色气体,写出产生无色气体的离子方程
式 。
(3)元素R与元素E的原子序数之比为2∶1,其单质直接反应后得到的化合物中元素质量比为1∶1,该化合物的化学式为________;该化合物_______(填“能”或“不能”)使品红溶液褪色。若含2 mol R元素的最高价氧化物对应水化物的浓溶液与足量的铜片反应,产生的气体在标准状况下的体积一定: 22.4 L(填“大于”,“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):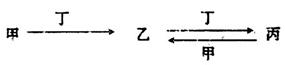
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示: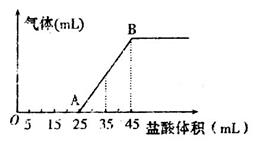
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):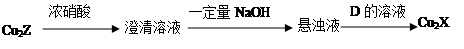
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com