
【题目】目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
实验Ⅰ:确定硫的质量:
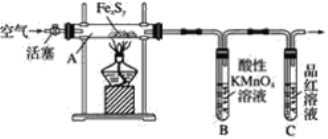
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL0.100mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至250mL 容量瓶,洗涤试管B后定容。取25.00mL该溶液用0.01mol·L-1的草酸(H2C2O4)溶液滴定剩余的KMnO4。记录数据如下:
滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO4-+2H2O+5SO2=2Mn2++5SO42-+4H+
②2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
实验Ⅱ:确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体 。
试回答下列问题:
(1)判断滴定终点的方法是__。
(2)试管C中品红溶液的作用是__。有同学提出,撤去C装置对实验没有影响,你的看法是__(选填“同意”或“不同意”),理由是__。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为__。
【答案】当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化 验证SO2是否被酸性KMnO4溶液完全吸收 同意 当B中溶液颜色不变化,即可证明SO2已被酸性KMnO4溶液完全吸收 Fe3S4
【解析】
由题中信息可知,该实验分为两个部分,首先,硬质玻璃管A中1.0g铁硫簇结构,在空气中加热,固体中的铁硫簇结构转变为红棕色的氧化铁红和二氧化硫,试管B中50mL0.100mol·L-1的酸性KMnO4溶液吸收反应生成的二氧化硫,再用0.01mol·L-1的草酸(H2C2O4)溶液滴定剩余的KMnO4,从而测定硫元素的质量;然后,将硬质玻璃管A中的残留固体用稀盐酸溶解,后再与足量的NaOH溶液反应生成氢氧化铁沉淀,沉淀经充分灼烧得0.6g氧化铁红,可以求出铁元素的质量。
(1)高锰酸钾溶液显色浅紫色,与草酸溶液反应后,自身被还原为Mn2+,溶液近乎无色,当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化,滴定达到终点;
(2)SO2可使品红溶液褪色,试管中C的作用是验证SO2是否被酸性KMnO4溶液完全吸收;如果撤去C装置,B中颜色不再发生变化时同样也可以证明二氧化硫被完全吸收;
(3)第1次滴定时H2C2O4溶液体积误差较大,舍去,第2、3次取平均值,V(H2C2O4)=25.00 mL。与H2C2O4反应的KMnO4的物质的量为0.01 mol·L-1×0.025 L×![]() =0.0001mol,与SO2反应的KMnO4的物质的量=0.05L×0.100 ol·L-1-10×0.0001mol=0.004 mol,n(SO2)=0.004mol×
=0.0001mol,与SO2反应的KMnO4的物质的量=0.05L×0.100 ol·L-1-10×0.0001mol=0.004 mol,n(SO2)=0.004mol×![]() =0.01 mol,n(S)=0.01mol;0.6 g固体为Fe2O3,n(Fe)=
=0.01 mol,n(S)=0.01mol;0.6 g固体为Fe2O3,n(Fe)=![]() ×2 mol=0.007 5 mol,
×2 mol=0.007 5 mol,![]() ,所以该铁硫簇结构的化学式为Fe3S4。
,所以该铁硫簇结构的化学式为Fe3S4。


科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4HC2O4-+H+ Ka1;HC2O4-C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
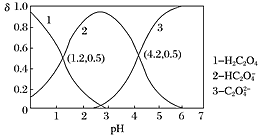
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH)+c(H2C2O4)
B.pH=2.7的溶液中: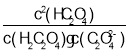 =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设KCl的摩尔质量为a g/mol, 20℃时某KCl饱和溶液的物质的量浓度为b mol/L,该溶液的密度为ρg/cm3 (ρ﹥1),下列说法不正确的是( )
A.20℃ KCl的溶解度为100ab/(1000ρ-ab) g
B.KCl的质量分数为(ab/1000ρ)×100%
C.将此溶液蒸发部分水再恢复到20℃,溶液密度一定大于ρ g/cm3
D.20℃密度小于ρ g/cm3的KCl溶液是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.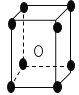 B.
B.
C.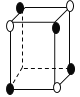 D.
D.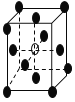
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__;此溶液中各离子的浓度由大到小的排列顺序是_____。
(2)若所得混合溶液的pH=2,则a∶b=____;此溶液中各种离子的浓度由大到小的排列顺序是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是______________________________

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:

则x=______
(3)若HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素位于短周期内,它们的原子序数依次递增。A原子核内仅有一个质子,B原子的电子总数与D原子最外层电子数相等。D原子最外层电子数是其电子层数的3倍。由此推断:
(1)A与D组成化合物中,含有非极性键的分子的电子式为___________
(2)B与D组成的化合物中,属于非极性分子的电子式为____________
(3)A与C组成的化合物分子式的电子式为____________属于_____分子。(填“极性”或“非极性”)
(4)已知A、B、C、D可组成一种化合物,且原子个数比8 :1 :2 :3该化合物的化学式为_______属于_____化合物(填“离子”或“共价”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com