
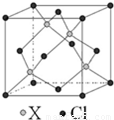
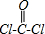 ,碳原子含有3个σ键,且不含孤电子对,所以采取sp2杂化,故答案为:sp2;3;
,碳原子含有3个σ键,且不含孤电子对,所以采取sp2杂化,故答案为:sp2;3;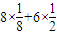 =4,X和氯离子个数比=4:4=1:1,所以其化学式为XCl,故答案为:XCl.
=4,X和氯离子个数比=4:4=1:1,所以其化学式为XCl,故答案为:XCl.

 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:

| I1/kJ?mol-1 | I2/kJ?mol-1 |
I3/kJ?mol-1 |
I4/kJ?mol-1 |
I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:
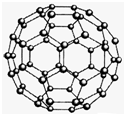 (2010?济南二模)【化学-物质结构与性质】
(2010?济南二模)【化学-物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
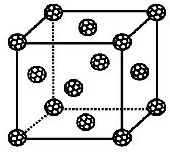 【化学-物质结构与性质】
【化学-物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
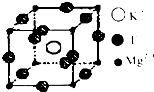 【化学--物质结构与性质】
【化学--物质结构与性质】- 2 |
- 3 |
- 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com