
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如下图所示,下列说法正确的是( )
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如下图所示,下列说法正确的是( )

A. C点时达到平衡状态
B. 该反应的H>0
C. 增加C的量能够增大SO2的转化率
D. T3时增大压强,能增大活化分子百分数
科目:高中化学 来源: 题型:
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中一lg![]() 和一lgc(HC2O42-)[或-lg
和一lgc(HC2O42-)[或-lg![]() 和-1gc(C2O42-)]的关系如图所示。下列说法正确的是
和-1gc(C2O42-)]的关系如图所示。下列说法正确的是

A. Ka1(H2C2O4)数量级为10-1
B. 曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中C(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1LpH=5的醋酸溶液中含有的H+数目小于10-5NA
B. 9.2g14CO2与N218O的混合物中所含中子数为4.8NA
C. 硝酸与铜反应生成0.1 mol NOx时,转移电子数为0.2NA
D. 1 molSO2和0.5molO2充分反应,生成SO3的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,则下列说法错误的是
2CO32-+6H2O,则下列说法错误的是
A. 放电时CH3OH参与反应的电极为正极
B. 充电时电解质溶液的pH逐渐增大
C. 放电时负极的电极反应式为:CH3OH-6e-+8OH-=CO32—+6H2O
D. 充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海世博会英国馆——种子圣殿,由六万多根透明的亚克力[其分子式是(C5H8O2)n]杆构建而成。某同学从提供的原料库中选择一种原料X,设计合成高分子亚克力的路线如图所示:

原料库:a.CH2=CHCH3 b.CH2=CHCH2CH3 c.CH2=C(CH3)2 d.CH(CH3)3
已知:①![]()
![]()
 (H)
(H)![]()
 (R、R'、R″表示烃基)。
(R、R'、R″表示烃基)。
请回答:
(1)原料X是____________(选填序号字母)。
(2)②所加试剂及反应条件是__________________;⑧的反应类型是____________;D中官能团的名称为_____________________。
(3)⑦的化学方程式是_____________________。
(4)C有多种同分异构体,其中分子中含有“![]() ”结构的共有________种。
”结构的共有________种。
(5)某同学以丙烯为原料设计了合成中间体D的路线:丙烯![]() ……D,得到D的同时也得到了另一种有机副产物M,请你预测M可能的结构简式是__________。
……D,得到D的同时也得到了另一种有机副产物M,请你预测M可能的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A(含有苯环的烃,化学式C8H8)和CCl4为原料合成苯丙氨酸E的流程如下:

已知:烃分子中的氢原子被卤素原子取代所生成的衍生物叫做卤代烃,如CH3CH2Cl;卤代烃在NaOH水溶液加热条件下会水解,如:
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
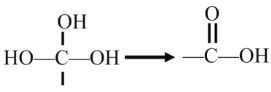 (该反应不需要条件就迅速转化)
(该反应不需要条件就迅速转化)
R-CH2CH2OH![]() R-CH=CH2+H2O
R-CH=CH2+H2O
(1)D→E的反应类型为_____________________。
(2)A的结构简式为________________________。
(3)有关D的叙述错误的是___________(填序号)。
a.能使酸性KMnO4溶液褪色 b.能与溴的CCl4溶液反应
c.能与甲醇发生酯化反应 d.能发生水解反应
(4)C→D反应的化学方程式为___________________________________。
(5)满足下列条件的E的同分异构体共有_________种。
①属于酯类;②苯环上只有两个对位取代基,其中一个为—NH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI![]() H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07 mol·L-1降到0.05 mol·L-1时,所需反应的时间为 ( )
A. 5 sB. 10 sC. 大于10 sD. 小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:

(1)元素⑩原子结构示意图为__________.
(2)元素③④的第一电离能大小关系为_______(填化学用语,下同),原因是__________________。④-⑧中最高价氧化物对应水化物酸性最强的是_______.
(3)写出元素⑦的最高价氧化物与NaOH溶液反应的离子方程式_________。
(4)元素⑤ 与⑧ 元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.两元素的电负性
C.单质分子中的键能
D.含氧酸的酸性
E.氢化物中X—H键的键长
F.两单质在自然界中的存在形式
(5)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;
在周期表中,最可能处于同一主族的是_________.(填元素代号),
②下列离子的氧化性最弱的是______________。
A.S2+ B.R2+ C.U+ D.T3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com