
【题目】用如图所示仪器,设计一个实验装置,用此装置电解饱和食盐水,并测定阴极气体的体积(约6mL)和检验阳极气体的氧化性。
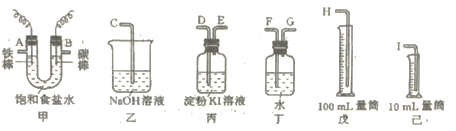
(1)必要仪器装置的接口字母顺序是:A接_____、____接____;B接___、____接____。
(2)电路的连接是:碳棒接电源的____极,电极反应方程式为_____。
(3)能说明阳极气体具有氧化性的实验现象是____,有关离子方程式是_____;最后尾气被吸收的离子方程式是______。
(4)如果装入的饱和食盐水体积为50mL(假定电解前后溶液体积不变),当测得的阴极气体为5.6mL(标准状况)时停止通电,则另一极实际上可收集到气体____(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)5.6mL,理由是______。
”)5.6mL,理由是______。
【答案】G F I D E C 正 2Cl--2e=Cl2↑ 丙中溶液变蓝 Cl2+2I-=I2+2Cl- Cl2+2OH-=Cl-+ClO-+H2O < 阳极产生的氯气有部分溶于水且与水和阴极产生的NaOH发生反应
【解析】
电解池装置中,阳极与电源的正极相连,阴极与电源的负极相连,电解饱和食盐水在阴极生成的是H2,阳极生成的是Cl2,据此分析;
淀粉遇碘单质变蓝,要从淀粉碘化钾中得到碘单质必须加入氧化性物质,据此分析;
根据已知的数据和电解的总反应方程式计算出生成的NaOH的物质的量浓度,从而可知c(OH-),再求溶液的pH,据此分析。
(1)碳棒上阴离子放电产生氯气,Fe棒上阳离子放电产生氢气,所以B端是检验氯气的氧化性,连接D,然后再进行尾气吸收,E接C,碳棒上阴离子放电产生氯气,Fe棒上阳离子放电产生氢气,所以A端是测定所产生的氢气的体积,即各接口的顺序是:A→G→F→I,B→D→E→C,故答案为:G;F;I;D;E;C;
(2)电解池装置中,碳与电源的正极相连,则为阳极,氯离子发生失电子的氧化反应,其电极反应式为:2Cl--2e-=Cl2↑,故答案为:正;2Cl--2e=Cl2↑;
(3)氯气氧化碘化钾,生成碘单质,碘单质遇淀粉溶液变蓝色,其离子方程式为:Cl2+2I-=I2+2Cl-;最后氢氧化钠溶液吸收多余的氯气,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:丙中溶液变蓝;Cl2+2I-=I2+2Cl-;Cl2+2OH-=Cl-+ClO-+H2O;
(4)n(H2)=![]() =0.00025mol,根据总反应方程式:2NaCl+2H2O
=0.00025mol,根据总反应方程式:2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH可知另一极理论上生成的氯气的物质的量也为0.00025mol,其体积理论上也为5.6mL,但氯气部分会溶于水,且部分会与生成的氢氧化钠反应,因此另一极实际上可收集到气体小于5.6mL,故答案为:<;阳极产生的氯气有部分溶于水且与水和阴极产生的NaOH发生反应。
H2↑+Cl2↑+2NaOH可知另一极理论上生成的氯气的物质的量也为0.00025mol,其体积理论上也为5.6mL,但氯气部分会溶于水,且部分会与生成的氢氧化钠反应,因此另一极实际上可收集到气体小于5.6mL,故答案为:<;阳极产生的氯气有部分溶于水且与水和阴极产生的NaOH发生反应。


科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
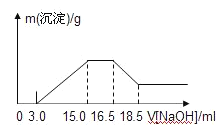
下列结论正确的是
A.铝与混合溶液反应的离子方程式为8Al+3OH-+3NO3-→8Al3++3NH4++9H2O
B.参加反应硝酸根离子物质的量为0.06 mol
C.参加反应的铝与镁的质量之比为4︰3
D.混合液中硫酸的物质的量的浓度为0.36 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成用四氯化碳制取碘水中的碘的相关实验内容(装置图见图 2)

图 2
(1)实验步骤:装液、振荡、静置和分层、_____。
(2)实验原理:利用碘在四氯化碳中的溶解度比在水中的溶解度_____;四氯化碳与水_____;
(3)实验现象:碘的四氯化碳溶液呈_____色;碘的四氯化碳溶液在_____层;
(4)注意事项:振荡时,须不断放气,以减小分液漏斗内压强。分液时,须将分液漏斗上的玻璃塞_____________,或使玻璃塞上的凹槽(或小孔)对准漏斗上的小孔;分液时,碘的四氯化碳溶液从分液漏斗_________口倒出,水从分液漏斗 _________口流出;漏斗颈的下端要紧贴烧杯的内壁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为___。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为__。
(4)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都为2H2+O2=2H2O。
①酸式氢氧燃料电池的电解质溶液是稀硫酸,其负极反应式为2H2-4e-=4H+,则其正极反应式为____。
②碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com