
【题目】已知氢化钾(KH)属于离子化合物,KH跟水反应可以放出氢气.下列说法中正确的是( )
A.KH的水溶液呈碱性
B.KH中氢离子可以被还原为氢气
C.KH是一种强氧化剂
D.KH中的氢离子是裸露的质子
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的. 已知:氧化性:IO3﹣>Fe3+>I2还原性:S2O32﹣>I﹣
反应式:3I2+6OH﹣═5I﹣+IO3﹣+3H2O,KI+I2KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+).用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色. ①该红色物质是(用化学式表示);CCl4中显示紫红色的物质是(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为;
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.写出潮湿环境中KI与氧气反应的化学方程式: . 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液: a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是(用编号填写).
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(填字母).
A.c(H+)
B.![]()
C.c(H+)c(OH﹣)
D.![]()
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式: .
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=(填准确数值).
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为 .
(6)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数. 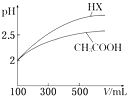
(7)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: ①c(OH﹣)=2c(H2CO3)+ .
②c(H+)+c(Na+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年一家制药公司首次在网站上悬赏下列化合物的合成路线,悬赏金额为$100000.该化合物的结构如图1:试回答下列问题: 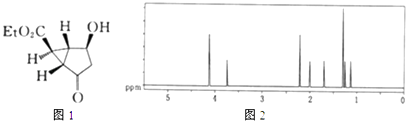
(1)上述结构式中Et表示乙基,该分子的化学式为 . 有机物归类时,母体优先顺序为酯>酸>醛(或酮)>醇等,则该分子所属类别是 .
(2)解决有机分子结构问题的手段之一是核磁共振.图2是计算机软件模拟出的该分子氢原子的核磁共振波谱图.氢原子在分子中的化学环境(原子之间相互作用)不同,其峰线在核磁共振谱图中就处于不同的位置;化学环境相同的氢原子越多,峰线的强度(高度)越大. 试参考该分子的结构简式分析谱图:该分子中共有种化学环境不同的氢原子;谱线最高者表示有个化学环境相同的氢原子;谱线最低者表示有个化学环境相同的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是周期表中的一部分,根据A﹣I的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | F | G | I | |||
3 | B | C | H |
(1)表中元素,化学性质最不活泼的是 .
(2)A﹣I元素中,非金属性最强的元素与金属性最强的元素形成的物质是 , 该物质的熔点比干冰的熔点(填“低”或“高”).
(3)比较D,E最高价氧化物的水化物酸性强弱 .
(4)G,H的氢化物沸点较高的是 , 理由是 .
(5)A,E,H组成的常见物质的电子式为 .
(6)用电子式表示E的氢化物的形成过程 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com